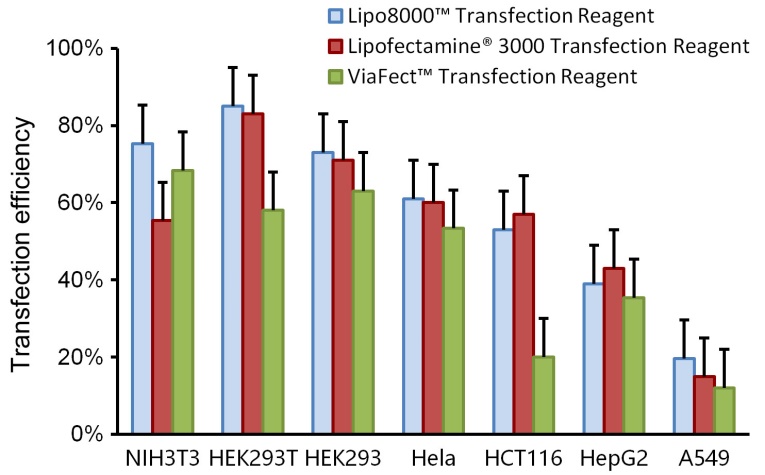
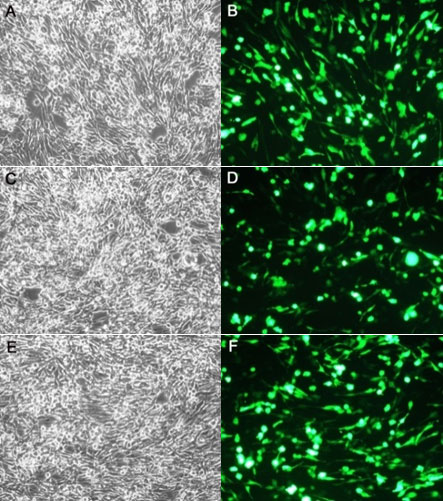
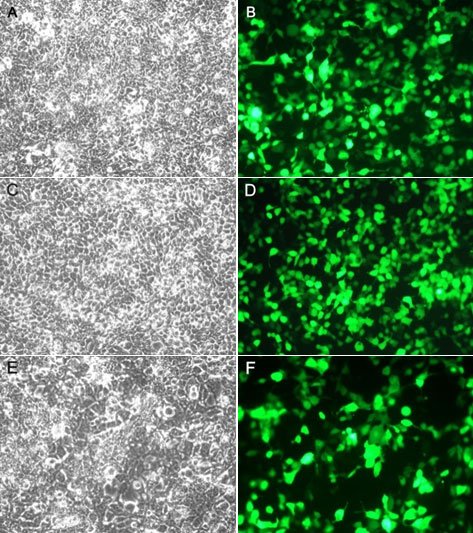
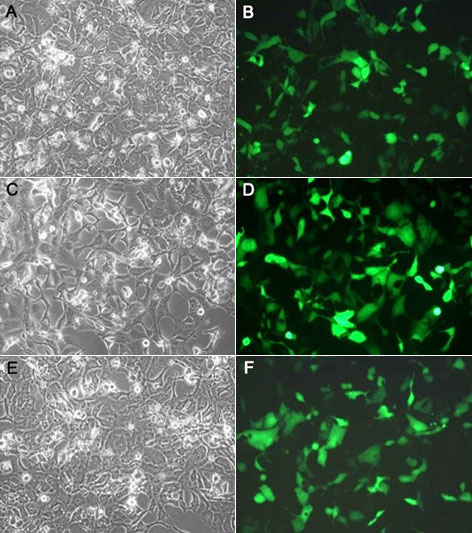
使用本产品的文献:
1. Xue S, Gong R, He F, Li Y, Wang Y, Tan T, Luo SZ
Sci Adv.
5(11):eaax5349.
(IF 13.116)
2. Xu Chen, Yihua Cai, Xiaoling Hu, Chuanlin Ding, Liqing He, Xiang Zhang, Fuxiang Chen, Jun Yan
Sci Adv.
doi: 10.1126/sciadv.abm9120.
(IF 13.116)
3. Qinggong Wang, Qiuyuan Lu, Qiong Guo, Maikun Teng, Qingguo Gong, Xu Li, Yang Du, Zheng Liu, Yuyong Tao
Nat Commun.
doi: 10.1038/s41467-022-28111-3.
(IF 12.121)
4. Gangwei Jiang, Tian-Bing Ren, Elisa D'Este, Mengyi Xiong, Bin Xiong, Kai Johnsson, Xiao-Bing Zhang, Lu Wang, Lin Yuan
Nat Commun.
doi: 10.1038/s41467-022-29547-3.
(IF 12.121)
5. Yansheng Zhai, Xiaoyan Huang, Keren Zhang, Yuchen Huang, Yanlong Jiang, Jingwei Cui, Zhe Zhang, Cookson K C Chiu, Weiye Zhong, Gang Li
Nat Commun.
doi: 10.1038/s41467-022-32689-z.
(IF 12.121)
6. Ji Wang, Caiguangxi Deng, Ming Liu, Yihao Liu, Liubing Li, Zhangping Huang, Liru Shang, Juan Jiang, Yongyong Li, Ruohui Mo, Hui Zhang, Min Liu, Sui Peng, Haipeng Xiao
Nat Commun.
doi: 10.1038/s41467-022-34633-7.
(IF 12.121)
7. Ruifang Wang, Yinxing Zhu, Chenwei Ren, Shuaike Yang, Shan Tian, Huanchun Chen, Meilin Jin, Hongbo Zhou
Autophagy.
doi: 10.1080/15548627.2020.1725375.
(IF 9.77)
8. Li Jia, Jun Li, Pengfei Li, Didi Liu, Jing Li, Jiechen Shen, Bojing Zhu, Chen Ma, Ting Zhao, Rongxia Lan, Liuyi Dang, Wang Li, Shisheng Sun
Theranostics.
doi: 10.7150/thno.56882.
(IF 8.579)
9. Yan Zhang, Huiwen Ding, Xiaoxiao Wang, Xin Wang, Shengpeng Wan, Anchun Xu, Ruoyi Gan, Shou-Dong Ye
Cell Rep.
doi: 10.1016/j.celrep.2021.109949.
(IF 8.109)
10. Chenyang Yi, Cong Cai, Ze Cheng, Yifan Zhao, Xu Yang, Yue Wu, Xiaoping Wang, Zehua Jin, Yaozu Xiang, Meilin Jin, Li Han, Anding Zhang
Cell Rep.
doi: 10.1016/j.celrep.2022.110559.
(IF 8.109)
11. Zilong Zheng, Guokai Yan, Xiuzhi Li, Yuke Fei, Lingling Sun, Haonan Yu, Yaorong Niu, Weihua Gao, Qing Zhong, Xianghua Yan
Cell Rep.
doi: 10.1016/j.celrep.2022.111850.
(IF 8.109)
12. Yaqi Bian, Yan Chen, Xiufen Wang, Guozhen Cui, Carolina Oi Lam Ung, Jia-Hong Lu, Weihong Cong, Benqin Tang, Simon Ming-Yuen Lee
J Adv Res.
doi: 10.1016/j.jare.2021.09.002.
(IF 6.992)
13. Yucheng Lu, Qingyun Liu, Zhiqi Huang, Xiuli Chen, Chunling Yang, Yueling Zhang, Yongzhen Zhao, Fan Wang
Genomics.
doi: 10.1016/j.ygeno.2022.110410.
(IF 6.205)
14. Chunming Gu, Wenhao Zhang, Enze Yang, Congyou Gu, Zhaoyang Zhang, Jing Ke, Xiong Wang, Shengying Wu, Shan Li, Fuyun Wu
Oncogenesis.
doi: 10.1038/s41389-022-00429-z.
(IF 6.119)
15. Xiaohui Wu, Jianqiang Ye, Weixing Cai, Xi Yang, Qiuying Zou, Jingjing Lin, Hui Zheng, Chaoyun Wang, Liangwan Chen, Yumei Li
Pharmacol Res.
doi: 10.1016/j.phrs.2021.106051.
(IF 5.893)
16. Miaomiao Chai, Ce Gu, Qihua Shen, Jiaxing Liu, Yi Zhou, Ziyang Jin, Wanli Xiong, Yan Zhou, Wensong Tan
Stem Cell Res Ther.
doi: 10.1186/s13287-020-01853-x.
(IF 5.116)
17. Ahui Song, Jingjing Wang, Yan Tong, Junyan Fang, Yi Zhang, Huiping Zhang, Hongqiang Ruan, Kai Wang, Yingli Liu
Stem Cell Res Ther.
doi: 10.1186/s13287-020-01952-9.
(IF 5.116)
18. Zhujun Yi, Yilin Wu, Wenfeng Zhang, Tao Wang, Jianping Gong, Yao Cheng, Chunmu Miao
Front Immunol.
doi: 10.3389/fimmu.2020.595316.
(IF 5.085)
19. Zhi-Chao Sun, Zeyin Jiang, Xiaowen Xu, Meifeng Li, Qing Zeng, Ying Zhu, Shanghong Wang, Yuanyuan Li, Xiao-Li Tian, Chengyu Hu
Front Immunol.
doi: 10.3389/fimmu.2021.762162.
(IF 5.085)
20. Meifeng Li, Jihuan Hu, Huiling Mao, Dongming Li, Zeyin Jiang, Zhichao Sun, Tingting Yu, Chengyu Hu, Xiaowen Xu
Front Immunol.
doi: 10.3389/fimmu.2021.808159.
(IF 5.085)
21. Jing Yang, Sheng Lin, Honglu Sun, Zimin Chen, Fanli Yang, Xi Lin, Liyan Guo, Lingling Wang, Ao Wen, Xindan Zhang, Yushan Dai, Bin He, Yu Cao, Haohao Dong, Xianbo Liu, Bo Chen, Jian Li, Qi Zhao, Guangwen Lu
Front Immunol.
doi: 10.3389/fimmu.2022.820336.
(IF 5.085)
22. Chen HY, He LJ, Li SQ, Zhang YJ, Huang JH, Qin HX, Wang JL, Li QY, Yang DL
Molecules.
24(15). pii: E2722.
(IF 3.267)
23. Guo Y, Nan X, Zhang X, Wang G, Ren Y, Wang Y, Fu Y, Hou J
FISH SHELLFISH IMMUN.
93:183-190.
(IF 3.298)
24. Tan Y, Jin Y, Wang Q, Huang J, Wu X, Ren Z
Cells.
8(10). pii: E1241.
(IF 4.366)
25. Tan Y, Jin Y, Wu X, Ren Z
BMC Mol Biol.
20(1):24.
(IF 1.658)
26. Hao Niu, Yiwei Huang, Li Yan, Li Zhang, Mengnan Zhao, Tao Lu, Xiaodong Yang, Zhengcong Chen, Cheng Zhan, Yu Shi, Qun Wang
Int J Biol Sci.
doi: 10.7150/ijbs.40173.
(IF 4.858)
27. Wenjun Li, Qian Du, Xiaoli Li, Xiangru Zheng, Feng Lv, Xin Xi, Guili Huang, Jia Yang, Songqing Liu
Front Pharmacol.
doi: 10.3389/fphar.2020.00114.
(IF 4.225)
28. Chuanhong Zhong, Bei Tao, Yitian Chen, Zhangchao Guo, Xiaobo Yang, Lilei Peng, Xiangguo Xia, Ligang Chen
ONCOTARGETS THER.
doi: 10.2147/OTT.S237841.
(IF 3.337)
29. Yang Liu, Yiling Ding, Yanting Nie, Mengyuan Yang
ONCOTARGETS THER.
doi: 10.2147/OTT.S240028.
(IF 3.337)
30. Fanhua Kong, Heng Zou, Xi Liu, Jun He, Yanwen Zheng, Li Xiong, Xiongying Miao
PHOTODIAGN PHOTODYN.
doi: 10.1016/j.pdpdt.2020.101663.
(IF 2.894)
31. Xu Bai, Yu Wang, Bo Hu, Qi Cao, Maochen Xing, Shuliang Song, Aiguo Ji
Mar Drugs.
doi: 10.3390/md18040220.
(IF 4.073)
32. Zhen-Yu She, Kai-Wei Yu, Ning Zhong, Yu Xiao, Ya-Lan Wei, Yang Lin, Yue-Ling Li, Ming-Hui Lu
RECENT PAT ANTI-CANC.
doi: 10.1038/s41420-020-0261-8.
(IF 2.61)
33. Xinna Du, Xuan Shen, Li Dai, Fangjie Bi, Hu Zhang, Chunfeng Lu
BIOCHEM BIOPH RES CO.
doi: 10.1016/j.bbrc.2020.03.095.
(IF 2.985)
34. Xue Han, Jielong Guo, Yilin You, Jicheng Zhan, Weidong Huang
FASEB J.
doi: 10.1096/fj.202000333R.
(IF 4.966)
35. Xiangru Zheng, Jinlai Wei, Wenjun Li, Xiaoli Li, Wuyi Wang, Jinbao Guo, Zhongxue Fu
AGING-US.
doi: 10.18632/aging.103690.
(IF 4.831)
36. Chengjie Xia, Wenyi Tang, Ping Geng, Haiyan Zhu, Wei Zhou, Hai Huang, Pei Zhou, Xunlong Shi
TOXICOL APPL PHARM .
doi: 10.1016/j.taap.2020.115131.
(IF 3.616)
37. Qiang An, Ting Liu, Ming-Yang Wang, Yu-Jia Yang, Zhen-Dong Zhang, Zhen-Jiang Lin, Bing Yang
ONCOTARGETS THER.
doi: 10.2147/OTT.S259033.
(IF 3.337)
38. Ya-Jing Liang, Jia-Hao Ni, Lan-Min Wang, Fu-Qing Tan, Wan-Xi Yang
Cell Tissue Res.
doi: 10.1007/s00441-020-03220-x.
(IF 4.044)
39. Xiaohan Zhang, Xian Lin, Chenghuang Qin, Kun Huang, Xiaomei Sun, Lianzhong Zhao, Meilin Jin
Front Microbiol.
doi: 10.3389/fmicb.2020.538355.
(IF 4.235)
40. Tingting Cheng, Yun Feng, Xiaoyan Chen, Jian Zhou, Yuanlin Song
Exp Cell Res.
doi: 10.1016/j.yexcr.2020.112155.
(IF 3.383)
41. Lihua Wang, Jicheng Zhan, Weidong Huang
Antioxidants (Basel).
doi: 10.3390/antiox9121200.
42. J-J Chen, P Lei, M Zhou
Clin Transl Oncol.
doi: 10.1007/s12094-020-02377-9.
(IF 2.737)
43. Xiaowei Li, Wenhua Zhu, Meiyang Fan, Jing Zhang, Yizhao Peng, Fumeng Huang, Nan Wang, Langchong He, Lei Zhang, Rikard Holmdahl, Liesu Meng, Shemin Lu
Comput Struct Biotechnol J.
doi: 10.1016/j.csbj.2021.04.001.
44. Xiaoqun Lv, Jinguo Zhang, Jun Zhang, Wencai Guan, Weifang Ren, Yujuan Liu, Guoxiong Xu
ONCOTARGETS THER.
doi: 10.2147/OTT.S282367.
(IF 3.337)
45. Liuli Li, Hao Li, Jun Zhang, Xin Gao, Hao Jin, Renqi Liu, Zhen Zhang, Xuan Zhang, Xichang Wang, Peng Qu, Yuejiao Zhao, Xiaobo Lu
J Cell Mol Med.
doi: 10.1111/jcmm.16279.
(IF 4.486)
46. Zhen-Yu She, Kai-Wei Yu, Ya-Lan Wei, Ning Zhong, Yang Lin
Cell Tissue Res.
doi: 10.1007/s00441-020-03341-3.
(IF 4.044)
47. Hua Lin, Weifeng Zeng, Yuhang Lei, Desheng Chen, Zhen Nie
Pathol Oncol Res.
doi: 10.3389/pore.2021.640936.
(IF 2.826)
48. Xiuzhi Li, Lingling Sun, Guokai Yan, Xianghua Yan
Cell Signal.
doi: 10.1016/j.cellsig.2021.109956.
(IF 3.968)
49. Xuan Ma, Yang Liu, Hao Tian, Bo Zhang, Meiling Wang, Xia Gao
J Microbiol Biotechnol.
doi: 10.4014/jmb.2102.02010.
50. Xiaohuan Wang, Long Li, Yingfeng Shao, Jiachen Wei, Ruopu Song, Songjie Zheng, Yuqiao Li, Fan Song
iScience.
doi: 10.1016/j.isci.2021.102945.
51. Keai Sinn Tan, Yihan Zhang, Lingling Liu, Sixu Li, Xinfeng Zou, Weiping Zeng, Guohua Cheng, Dongfang Wang, Wen Tan
Comp Biochem Physiol B Biochem Mol Biol.
doi: 10.1016/j.cbpb.2021.110590.
52. Qiao-Qiao Han, Meng-Yan Deng, Hao Liu, Usman Ali, Xin-Yan Li, Yong-Xiang Wang
Biochem Pharmacol.
doi: 10.1016/j.bcp.2021.114600.
(IF 4.96)
53. Yadong Fu, Zhun Xiao, Xiaoting Tian, Wei Liu, Zhou Xu, Tao Yang, Yonghong Hu, Xiaoxi Zhou, Jing Fang, Siqi Gao, Dingqi Zhang, Yongping Mu, Hua Zhang, Yiyang Hu, Chenggang Huang, Jiamei Chen, Ping Liu
Front Pharmacol.
doi: 10.3389/fphar.2021.671152.
(IF 4.225)
54. Ran Xu, Le Kang, Siang Wei, Chunjie Yang, Yuanfeng Fu, Zhiwen Ding, Yunzeng Zou
Front Cardiovasc Med.
doi: 10.3389/fcvm.2021.748156.
55. Dong-Lin Yang, Ya-Jun Zhang, Liu-Jun He, Chun-Sheng Hu, Li-Xia Gao, Jiu-Hong Huang, Yan Tang, Jie Luo, Dian-Yong Tang, Zhong-Zhu Chen
Biol Res.
doi: 10.1186/s40659-021-00350-6.
(IF 3.092)
56. Chengchen Wu, Junyi Zhao, Qiuping Wu, Qiulong Tan, Qiong Liu, Shifeng Xiao
Int J Mol Sci.
doi: 10.3390/ijms22189728.
(IF 4.556)
57. Rui Wang, Jian Liu, Kai Li, Ganghua Yang, Sisi Chen, Jie Wu, Xinming Xie, Hong Ren, Yamei Pang
J Exp Clin Cancer Res.
doi: 10.1186/s13046-021-02119-x.
58. Sheng Li, Leilei Zhang, Guoan Zhang, Guoqiang Shangguan, Xitan Hou, Wanglin Duan, Yan Xi, Nan Xu, Bowen Zhang, Junli Dong, Yequan Wang, Wen Cui, Su Chen
iScience.
doi: 10.1016/j.isci.2021.103296.
59. Xiufang Ding, Siyu Gu, Song Xue, Shi-Zhong Luo
Brain Res.
doi: 10.1016/j.brainres.2021.147589.
(IF 2.733)
60. Yunyi Bian, Qihai Sui, Guoshu Bi, Yuansheng Zheng, Mengnan Zhao, Guangyu Yao, Liang Xue, Yi Zhang, Hong Fan
Dis Markers.
doi: 10.1155/2021/3219594.
(IF 2.738)
61. Fanzhen Yu, Yingxin Wang, Yilong Teng, Shutong Yang, Yanming He, Zeng Zhang, Hongjie Yang, Chuan-Fan Ding, Ping Zhou
ACS Omega.
doi: 10.1021/acsomega.1c04244.
(IF 2.87)
62. Xiangjie Wang, Shuang Liu, Bin Xu, Yabin Liu, Peng Kong, Changlin Li, Binghui Li
Anal Cell Pathol (Amst).
doi: 10.1155/2021/5739769.
63. Yue Wu, Tian Tian, Yin Wu, Yu Yang, Yunfei Zhang, Ximing Qin
Biology (Basel).
doi: 10.3390/biology10111204.
64. Haorui Zhang, Bocen Chen, Zixiu Zou, Jian Feng, Yutao Li, Yi Wang, Xing He, Chang Xu, Haijian Wang, Shicheng Guo, Li Jin, Qiang Li, Jiucun Wang, Man Xiao, Feng Li, Junjie Wu
Front Oncol.
doi: 10.3389/fonc.2021.757484.
(IF 4.848)
65. Yang Zhou, Hui Yan, Qiang Zhou, Ruiling Feng, Penggao Wang, Fang Yang, Yaodong Zhang, Ziqiao Yuan, Bo Zhai
Front Pharmacol.
doi: 10.3389/fphar.2021.766909.
(IF 4.225)
66. Yuanlin Yu, Xiaopeng Chen, Weidong Zhang, Jun Liu
Biomed Res Int.
doi: 10.1155/2021/4051192.
(IF 2.276)
67. Suping Han, Yafan Yang, Yanan Lu, Jielong Guo, Xue Han, Yunxiao Gao, Weidong Huang, Yilin You, Jicheng Zhan
Antioxidants (Basel).
doi: 10.3390/antiox10121986.
68. Xiaoling Liu, Ziqi Wang, Xintong Song, Xinyu Chang, Er Zu, Xiaowei Ma, Momoe Sukegawa, Dongchun Liu, Dan Ohtan Wang
J Agric Food Chem.
doi: 10.1021/acs.jafc.1c04570.
69. Menglin Zou, Jingfeng Zou, Xingxing Hu, Weishuai Zheng, Mingyang Zhang, Zhenshun Cheng
Front Pharmacol.
doi: 10.3389/fphar.2021.788714.
(IF 4.225)
70. Yan Wang, Chun Jie Wu, Yu Du, Yu Qing Liu, Jing Ran Cai, Xue Qing Wu, Shu Qun Hu
Free Radic Res.
doi: 10.1080/10715762.2021.2024529.
71. Mingfang Huang, Xuqiang Liao, Liang Li, Gao Li, Minbiao Chen
Tissue Cell.
doi: 10.1016/j.tice.2021.101672.
(IF 1.837)
72. Guiyuan Liu, Dengxiang Lai, Yi Jiang, Hongjing Yang, Hui Zhao, Yonghui Zhang, Dan Liu, Yi Pang
Anticancer Agents Med Chem.
doi: 10.2174/1871520621666210608104021.
73. Xin He, Juan Wang, Ru Zhou, Shanshan Yu, Jue Jiang, Qi Zhou
Toxicol Appl Pharmacol.
doi: 10.1016/j.taap.2021.115834.
74. Shuting Li, Chenglan Jiang, Jingwen Tan, Qian Zhou, Jinyao Yin, Yuefeng He
Environ Sci Pollut Res Int.
doi: 10.1007/s11356-021-15891-2.
75. Jun Wang, Beidi Wang, Biting Zhou, Jing Chen, Jia Qi, Le Shi, Shaojun Yu, Guofeng Chen, Muxing Kang, Xiaoli Jin, Lie Wang, Jinghong Xu, Linghua Zhu, Jian Chen
Cancer Cell Int.
doi: 10.1186/s12935-022-02493-2.
(IF 4.175)
76. Gaojian Zhang, Jianxiong Han, Lili Wang, Xuegang Yang, Zhongkang Yan, Min Qu, Huijuan Zhou, Hazrat Bilal, Feifei Wang, Honghua Ge, Xingyuan Yang
iScience.
doi: 10.1016/j.isci.2022.104085.
77. Hongchao Zhou, Yuting Zhang, Jingjing Wang, Yuchao Yan, Yi Liu, Xiaojie Shi, Qi Zhang, Xingang Xu
Front Microbiol.
doi: 10.3389/fmicb.2022.831852.
(IF 4.235)
78. Guoshu Bi, Jiaqi Liang, Mengnan Zhao, Huan Zhang, Xing Jin, Tao Lu, Yuansheng Zheng, Yunyi Bian, Zhencong Chen, Yiwei Huang, Valeria Besskaya, Cheng Zhan, Qun Wang, Lijie Tan
Mol Ther Nucleic Acids.
doi: 10.1016/j.omtn.2022.03.020.
79. Mengnan Zhao, Ming Li, Yuansheng Zheng, Zhengyang Hu, Jiaqi Liang, Guoshu Bi, Yunyi Bian, Qihai Sui, Cheng Zhan, Miao Lin, Qun Wang
J Cancer.
doi: 10.7150/jca.68568.
(IF 3.565)
80. Zhuo-Hang Li, Xia Li, Fang-Fang Li, Zhi-Hong Wu, You-Long Xie, Shuang Zhang, Xue-Mei Chen, Ying-Xiong Wang, Yu-Bin Ding, Tai-Hang Liu
Mol Hum Reprod.
doi: 10.1093/molehr/gaac014.
(IF 3.636)
81. Wenxia Ren, Miaomiao Chai, Mingli Jiang, Yan Zhou, Wensong Tan
Mol Biol Rep.
doi: 10.1007/s11033-021-07082-6.
(IF 1.402)
82. Jikai Xu, Jingyu Liu, Yan Mi, Ting Zhao, Danyang Mu, Qingqi Meng, Feng Wang, Ning Li, Yue Hou
J Agric Food Chem.
doi: 10.1021/acs.jafc.2c01219.
83. Liying Dong, Meng Wang, Xiaolei Gao, Xuan Zheng, Yixin Zhang, Liangjie Sun, Na Zhao, Chong Ding, Zeyun Ma, Yixiang Wang
PeerJ.
doi: 10.7717/peerj.13360.
(IF 2.379)
84. Mengchan Zhu, Ling Ye, Guiping Zhu, Yingying Zeng, Chengyu Yang, Hui Cai, Yuqing Mo, Xixi Song, Xin Gao, Wenjun Peng, Jian Wang, Meiling Jin
Oxid Med Cell Longev.
doi: 10.1155/2022/5695005.
(IF 5.076)
85. Xingang Xu, Lixiang Wang, Yi Liu, Xiaojie Shi, Yuchao Yan, Shuxia Zhang, Qi Zhang
J Gen Virol.
doi: 10.1099/jgv.0.001748.
(IF 3.376)
86. Yanmin Zhang, Weijian Zhang, Jun Cheng, Xuping Liu, Shiwei Miao, Wen-Song Tan, Liang Zhao
Appl Microbiol Biotechnol.
doi: 10.1007/s00253-022-11919-w.
87. Wang Bingxiang, Zhao Ningning, Wang Yakun, Sun Lingyu, Li Hongmei, Xiao Zhang, Xiaomin Zhao
Parasitol Res.
doi: 10.1007/s00436-022-07499-3.
(IF 1.641)
88. Xiangyou Yu, Ning Jiang, Jing Li, Xiaofeng Li, Shenglin He
Tissue Cell.
doi: 10.1016/j.tice.2022.101813.
(IF 1.837)
89. Ning Jiao, Wan Sheng Ji, Biao Zhang, Yu Kui Shang, Yu Chen Zhang, Wei Qun Yu, Hai Long Jin, Chao Li, Cheng Ying Zhang, Cheng Yan, Wen Yue, Qing Zhang
Biomed Environ Sci.
doi: 10.3967/bes2022.082.
(IF 2.656)
90. Haijun Cai, Hui Guo, Yixuan Deng, Jinhai Jiang, Siyuan Liu, Wenge He, Huagang Jian
Exp Ther Med.
doi: 10.3892/etm.2022.11542.
(IF 1.785)
91. Xiong Li, Jingwen Liu, Yan Zhou, Luman Wang, Yifan Wen, Kun Ding, Lu Zou, Xia Liu, Aiping Li, Yun Wang, Heling Fu, Min Huang, Guoxian Ding, Jianwei Zhou
Int J Biol Sci.
doi: 10.7150/ijbs.72751.
(IF 4.858)
92. Xiao-Qiang Li, Bo-Chuan Liu, Xiao-Bing Jiang, Wen-Wen Gao, Bo Rong, Yao Wei, Feng-Lu Wang, Hai-Kang Zhao, Liang Zhang
Toxicol Appl Pharmacol.
doi: 10.1016/j.taap.2022.116180.
93. Qiyang Yao, Xin Zou, Shihe Liu, Haowen Wu, Qiyang Shen, Jihong Kang
Int J Mol Sci.
doi: 10.3390/ijms231911384.
(IF 4.556)
94. Yang Liang, Yuefeng Qin, Guoyun Jiang, Wenli Feng, Ying Yuan
Med Oncol.
doi: 10.1007/s12032-022-01821-w.
(IF 2.834)
95. Wenpeng Zhao, Maolin Xu, Herman W Barkema, Xiaochen Xie, Yushan Lin, Sohrab Khan, John P Kastelic, Dong Wang, Zhaoju Deng, Bo Han
Front Immunol.
doi: 10.3389/fimmu.2022.934819.
(IF 5.085)
96. Jing Tian, Lei Cheng, Enqi Kong, Wenjin Gu, Yuanyuan Jiang, Quan Hao, Beihua Kong, Li Sun
Reprod Biol Endocrinol.
doi: 10.1186/s12958-022-00995-2.
97. Xiaolong Zhang, Lifei Tian, Zeyu Li, Ruiting Liu, Jiao Yu, Bo Liu
Biochem Biophys Res Commun.
doi: 10.1016/j.bbrc.2022.08.036.
98. Hui Jiang, Feng Chen, DianZe Song, Xiaoqin Zhou, Long Ren, Mei Zeng
Oxid Med Cell Longev.
doi: 10.1155/2022/5064494.
(IF 5.076)
99. Cui Shengyu, Luo Yinhua, Li Yuanhong, Zhao Jinbo, Fang Can, Xia Hao, Zhang Changjiang
Int Immunopharmacol.
doi: 10.1016/j.intimp.2022.109158.
(IF 3.943)
100. Xiaoyan Ren, Jiangang Yu, Lili Guo, Zaili Zhang
Metab Brain Dis.
doi: 10.1007/s11011-022-01043-z.
(IF 2.726)
101. Wen-Ying Yang, Xiang Meng, Yue-Rong Wang, Qing-Qing Wang, Xin He, Xiao-Yu Sun, Nan Cheng, Lei Zhang
Acta Odontol Scand.
doi: 10.1080/00016357.2022.2047780.
(IF 1.573)
102. Guanping Chen, Yuedong Li, Xiangshuo Kong, Shudi Zhao, Jiale Li, Xiaofeng Wu
Viruses.
doi: 10.3390/v14122636.
103. Zhuo Zhang, Xu Zhang, Xin Wu, Yan Zhang, Jie Lu, Dan Li
Cereb Cortex.
doi: 10.1093/cercor/bhac007.
(IF 5.043)
104. Xiaopeng Hu, Jiahua Cui, Jun Chen, Shujuan Du, Xinyu Wang, Yabin Zhang, Jiajun Qian, Haifeng Chen, Fang Wei, Qiliang Cai, Jinping Jia, Ji Wu
Virus Res.
doi: 10.1016/j.virusres.2022.198915.
(IF 2.934)
105. Xiangqi Hao, Hui Chen, Yanchao Li, Bo Chen, Weifeng Liang, Xiangyu Xiao, Pei Zhou, Shoujun Li
BMC Vet Res.
doi: 10.1186/s12917-022-03539-3.
(IF 1.835)
106. Qirong Lu, Pu Guo, Houpeng Li, Yanan Liu, Ling Yuan, Boyue Zhang, Qinghua Wu, Xu Wang
Ecotoxicol Environ Saf.
doi: 10.1016/j.ecoenv.2022.114243.
107. Fanting Zeng, Yuhang Peng, Yuefeng Qin, Jianming Wang, Guoyun Jiang, Wenli Feng, Ying Yuan
Cell Commun Signal.
doi: 10.1186/s12964-022-01021-z.
(IF 4.344)
108. Adrian On-Wah Leung, Tsz-Ching Yiu, Lingxiao Liu, Hei-Yin Tam, Shen Gu, Jiajie Tu, Duanqing Pei, Hoi-Hung Cheung
Cell Biosci.
doi: 10.1186/s13578-022-00939-8.
(IF 5.026)
109. Tingyan Yao, Junge Zhu, Xiao Wu, Xuying Li, Yongjuan Fu, Yuan Wang, Zhanjun Wang, Fanci Xu, Hong Lai, Aini He, Lianghong Teng, Chaodong Wang, Haiqing Song
Neurol Genet.
doi: 10.1212/NXG.0000000000200044.
110. Yihui Xu, Bao Ren, Min Wang
Clin Transl Oncol.
doi: 10.1007/s12094-022-03055-8.
(IF 2.737)
111. Hao-Zheng Li, Ya-Fen Wang, Xiao-Xia Shao, Ya-Li Liu, Zeng-Guang Xu, Shi-Long Wang, Zhan-Yun Guo
FEBS J.
doi: 10.1111/febs.16765.
(IF 4.392)