碧云天的钙含量显色检测试剂盒(Calcium Colorimetric Assay Kit),也称钙含量检测试剂盒(Calcium Assay Kit)或钙离子含量检测试剂盒(Calcium Ion Assay Kit),是一种通过比色法快速定量检测细胞、组织、血清、血浆、尿液、培养液等样品中钙离子含量的检测试剂盒。
本试剂盒使用便捷:液体样品可直接检测,细胞、组织样品只需简单处理即可检测;检测快速,检测过程最快仅需10分钟。
本试剂盒线性范围宽、灵敏度高:在0.2-2µg钙离子量范围内有良好的线性关系,最低可检测0.1µg的钙离子。
钙(calcium)通常是哺乳动物机体内最为丰富的矿物质,参与调控众多的细胞生命活动过程,也是最为重要的细胞内调控因子之一。钙能够以自由离子或结合钙离子的复合物两种形式存在,例如磷酸钙和碳酸钙复合物即为骨骼组织的组成成分。包括肌肉收缩、细胞粘附、激素/神经递质释放、糖原代谢、细胞增殖/分化、血凝、神经或突触传递以及骨骼结构支持在内的大量生理过程都受到钙信号的调控。细胞特异性钙信号系统完整性的缺陷会导致一些疾病的发生。
虽然人体内99%的钙存在于骨骼和牙齿中,但临床上非常关注血液的钙水平,即血钙。血钙水平主要通过甲状旁腺激素调节骨骼储存钙或者释放钙,以避免血钙过高或者过低。血清中的钙主要以三种形式存在:约50%的游离钙离子、约45%的蛋白结合钙、约5%的钙复合物(主要是柠檬酸钙)。钙的水平通常和磷的水平负相关。
邻甲酚酞络合酮(o-cresolphthalein complexone,OCPC)比色法是一种便捷、高灵敏度、高稳定性的钙检测技术。钙离子与邻甲酚酞络合酮在碱性条件下反应产生紫色复合物,通过检测575nm处的吸光度即可定量检测钙离子含量。本试剂盒的检测原理参见图1。

图1. 本钙含量显色检测试剂盒的检测原理图。
本试剂盒每个包装可进行200次检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| S1063S-1 | 样品裂解液 | 50ml |
| S1063S-2 | 检测缓冲液 | 15ml |
| S1063S-3 | 显色液 | 15ml |
| S1063S-4 | 钙标准品(500mM) | 0.2ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。S1063S-3显色液需要避光保存。
注意事项:
所有样品的pH应在6-8之间。pH值过高或者过低都会影响结果的准确性。
在样品加样和混匀过程中,请务必轻柔操作,避免产生气泡,否则可能影响最终检测结果。
如果不能非常严格地控制反应温度和反应时间,每次检测都需要设置标准曲线。
检测缓冲液及显色液使用前需平衡至室温。检测缓冲液与显色液混合配制而成的工作液需现用现配,建议在30分钟内使用。
血浆样品制备时,抗凝剂可以使用肝素,不能使用柠檬酸盐、EDTA以及其它类似的会与钙离子结合的物质。
螯合剂(如EDTA、EGTA等)、柠檬酸盐、草酸盐、氟化钠等氟化物等可以和钙离子结合的物质会干扰本试剂盒的检测。
对于钙离子浓度过高或过低而不在标准曲线范围内的样品,需适当调整样品量,使钙离子浓度在标准曲线的线性范围内。
检测缓冲液(S1063S-2)和显色液(S1063S-3)对人体有害,操作时请小心,并注意有效防护以避免直接接触人体或吸入体内。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 样品的准备
注:尽量使用新鲜样品,如果不能及时检测,请根据如下方法处理样品并妥善保存。样品冻存可能会影响样品的稳定性并导致检测数值低于预期结果。初次检测时,建议先尝试设置几个不同稀释度的样品,以保证有适当稀释度的样品检测数值在线性范围内。
a. 组织样品的准备:
(a) 把组织剪切成细小的碎片。
(b) 融解样品裂解液,混匀。
(c) 按照每20毫克组织加入100-200µl的比例加入样品裂解液(如果裂解不充分可以适当添加更多的裂解液,如果需要高浓度的样品,可以适当减少裂解液的用量),用适当的研磨仪(如碧云天的E6600 TissueMaster™手持式组织研磨仪)或玻璃匀浆器匀浆,直至充分裂解。
(d) 充分裂解后,4℃ 10,000-14,000g离心3-5分钟,取上清,冰上放置待测。
(e) 如果当天不进行检测,将样品置于-80℃冷冻保存。后续检测时取出后在冰上融化。处理好的组织样品请在一个月内使用,并避免反复冻融。
b. 细胞样品的准备:
(a) 融解样品裂解液,混匀。
(b) 对于贴壁细胞:去除培养液,用PBS、生理盐水或无血清培养液洗一遍。按照6孔板每孔加入100-200µl的比例加入样品裂解液。用枪吹打数下,使样品裂解液和细胞充分接触。通常裂解液接触细胞1-2秒后,细胞就会被裂解。
(c) 对于悬浮细胞:4℃ 600g离心5分钟收集细胞,弃上清,用力把细胞弹散。按照6孔板每孔细胞加入100-200µl裂解液的比例加入样品裂解液。再用手指轻弹以充分裂解细胞。充分裂解后应没有明显的细胞沉淀。如果细胞量较多,必需分装成50-100万细胞/管,然后再裂解。注:大团的细胞较难裂解充分,而少量的细胞由于裂解液容易和细胞充分接触,相对比较容易裂解充分。
(d) 充分裂解后,4℃ 10,000-14,000g离心3-5分钟,取上清,冰上放置待测。
(e) 样品裂解液用量说明:通常6孔板每孔细胞加入100µl样品裂解液,但如果细胞密度非常高可以适当加大裂解液的用量至150µl或200µl。
(f) 如果当天不进行检测,将样品置于-80℃冷冻保存,检测时取出于冰上融化。处理好的细胞样品请在一个月内使用,并避免反复冻融。
c. 血清、血浆、尿液及培养液等液体样品的准备:
(a) 制备血清时建议使用肝素,避免使用EDTA类的螯合剂,因为螯合剂会和钙离子结合而影响检测结果。
(b) 生物液体样品及其它液体样品可直接检测。
(c) 建议适当稀释样品以获得最佳检测结果及保证检测数值在线性范围内。此处的样品稀释倍数记录为n。
(d) 如果当天不进行检测,推荐将样品置于-80℃冷冻保存,检测时取出于冰上融化。处理好的样品请在一个月内使用,并避免反复冻融。
2. 试剂盒的准备工作:
a. 检测缓冲液及显色液使用前应平衡至室温。
b. 标准品的制备
钙标准溶液的制备:取10µl 500mM的钙标准品,加入990µl去离子水,充分混匀后即可得到5mM的钙标准溶液。
参考下表稀释钙标准品,制备0、0.1、0.2、0.4、0.6、0.8、1.0mM浓度标准品。(备选:如果样品中钙含量比较高,可以考虑制备0、1、2、4、6、8、10mM浓度标准品,此时样品和标准品的用量须减少至5µl,详见步骤3b。)
| 标准品编号 | 5mM钙标准溶液(µl) | 去离子水(µl) | 上样量(µl/well) | 钙离子浓度(mM) | 钙离子量(µg/well) |
| 1 | 0 | 150 | 50 | 0 | 0 |
| 2 | 3 | 147 | 50 | 0.1 | 0.2 |
| 3 | 6 | 144 | 50 | 0.2 | 0.4 |
| 4 | 12 | 138 | 50 | 0.4 | 0.8 |
| 5 | 18 | 132 | 50 | 0.6 | 1.2 |
| 6 | 24 | 126 | 50 | 0.8 | 1.6 |
| 7 | 30 | 120 | 50 | 1.0 | 2.0 |
注1:保证每个稀释度足够两个重复孔的使用量,如果重复孔更多,相应体积成比例增加即可。
注2:根据钙的原子量为40,可以从摩尔浓度和体积计算出每孔的钙离子量。
c. 检测工作液的配制:计算一次实验所需用量,把检测缓冲液与显色液以1:1混合配制成检测工作液待用。
注意:检测工作液需现用现配,时间太长可能会失效,建议配制好的检测工作液在30分钟内使用。
3. 标准曲线的绘制及样品测定:
a. 每个浓度标准品及样品推荐检测2个重复孔。
b. 96孔板中每孔加入50µl标准品或样品。样品也可2-50µl任意体积,并用去离子水补平到50µl,样品体积记录为V。(备选:如果样品中钙离子浓度比较高,可以考虑制备0、1、2、4、6、8、10mM浓度标准品,并且标准品和样品的用量全部都是5µl,样品可以使用1-5µl的任意体积,但须用去离子水补平到5µl。)
c. 每孔加入150µl检测工作液,混匀。
d. 室温避光孵育5-10分钟。注:须在30分钟内完成吸光度检测,时间过长所产生的颜色会逐渐变淡,从而影响检测效果。
e. 酶标仪测量575nm处的吸光度,制作标准曲线。
4. 样品中钙含量的计算:
a. 计算标准品组中每个浓度组的平均吸光度,减去空白对照组的吸光度,即为各个浓度标准品的吸光度。
b. 以钙标准品的钙离子量为横坐标,吸光度为纵坐标,绘制出标准曲线。钙离子的标准曲线可以参考图2。
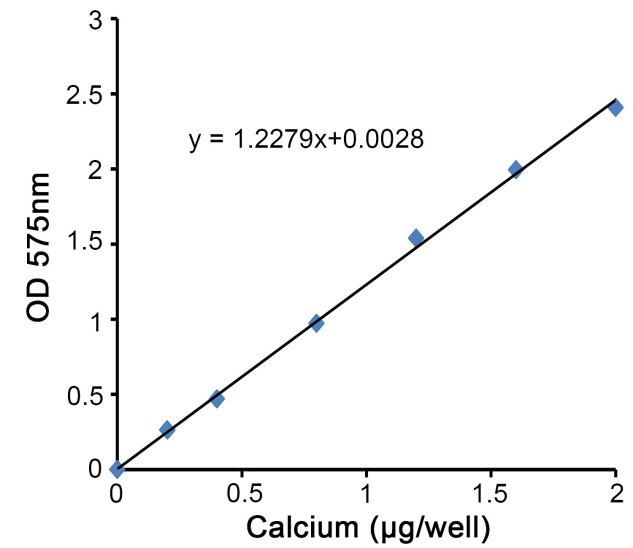
图2. 本钙含量显色检测试剂盒检测钙离子的标准曲线图。实测数据会因实验条件、检测仪器等的不同而存在差异,图中数据仅供参考。
c. 根据标准曲线计算测试孔中的钙含量。
d. 根据如下计算公式,计算样品中钙浓度:
C = A×n/V (µg/µl) 或 C = (A×n/V)/40 (mol/L)
注:A为根据标准曲线确定的钙离子量(µg)
n为步骤1中样品稀释倍数
V为步骤3中加入的样品体积
40为钙的原子量
相关产品:
| 产品编号 | 产品名称 | 包装 |
| S1052 | Fura-2 AM (钙离子荧光探针, 2mM) | 50微升 |
| S1056 | Fluo-3 AM (钙离子荧光探针, 5mM) | 20微升 |
| S1060 | Fluo-4 AM (钙离子荧光探针, 2mM) | 25微升 |
| S1063S | 钙含量显色检测试剂盒 | 200次 |