碧云天的脂肪酸摄取荧光检测试剂盒(绿色荧光标记月桂酸) (Fluorometric Fatty Acid Uptake Assay Kit with Lauric Acid Labeled with Green Fluorescence)、也称脂肪酸摄取荧光染色试剂盒、Fluorometric Fatty Acid Uptake Staining Kit、脂肪酸摄取检测试剂盒(Fatty Acid Uptake Kit),是一种以BODIPY标记的月桂酸为绿色荧光探针,快速高灵敏地检测细胞脂肪酸摄取能力或进行脂肪酸摄取抑制剂筛选的试剂盒。本试剂盒可使用荧光显微镜、激光共聚焦显微镜、荧光酶标仪、流式细胞仪等荧光检测系统进行检测。
BODIPY标记月桂酸(BODIPY-labeled Lauric Acid),也称BODIPY 500/510 C1, C12、C1-BODIPY 500/510 C12、BODIPY标记十二烷酸,是一种BODIPY荧光标记的饱和脂肪酸,可以被细胞摄取而进入细胞内部,可以对细胞内的极性脂类进行定位示踪,常作为荧光探针用于脂肪酸摄取、脂质转运、肠道脂质吸收、脂肪或肝脏等组织脂质的吸收和累积等研究,或作为通用型膜探针对细胞膜进行染色等,也可用作各种荧光磷脂的合成前体,适用于荧光显微镜、激光共聚焦显微镜、流式细胞仪、荧光酶标仪等荧光检测系统。
BODIPY荧光基团本质上是亲脂性的,所以可以模拟天然脂质的性质。该系列染料在不同生理条件下相对稳定,对环境的极性和pH值相对不敏感,由于其结构具有非对称性,故有多种衍生结构产物,BODIPY标记月桂酸即为其中一种。BODIPY标记月桂酸的分子式为C22H31BF2N2O2,分子量为404.3,在被活细胞摄取后,可形成激发二聚体并发射红移荧光,最大激发波长为500nm,最大发射波长为510nm。
本试剂盒组分齐全,使用便捷。本试剂盒提供的BODIPY标记月桂酸为1000X储存液,该溶液经过优化,对大多数细胞都适用;抑制剂阳性对照试剂FA-Blocker是一种脂肪酸转运蛋白的抑制剂,可抑制脂肪酸转运到细胞中。同时,本试剂盒提供Assay Buffer,使用更便捷。本试剂盒也提供了Hoechst 33342染色液,方便同时观察细胞核染色情况。使用本试剂盒检测HeLa细胞内脂肪酸摄取的效果参考图1和图2。

图1.碧云天脂肪酸摄取荧光检测试剂盒(绿色荧光标记月桂酸) (S0576)对HeLa细胞的荧光酶标仪检测和流式检测效果图。使用脂肪酸转运蛋白抑制剂FA-Blocker处理细胞后,无论是未经处理的HeLa细胞(Control)还是经油酸(Oleic acid)处理后的HeLa细胞,经荧光酶标仪检测(图A)和流式细胞仪检测(图B)荧光强度均显著降低(Control与FA-Blocker进行比较;Oleic acid与Oleic acid+FA-Blocker进行对比)。图中酶标仪检测激发波长为500nm,发射波长为520nm,波长宽度为5nm,顶读;流式细胞仪检测通道为FITC (Ex/Em=488/525)。实际检测效果会因实验条件、检测仪器的不同而存在差异,图中效果仅供参考。
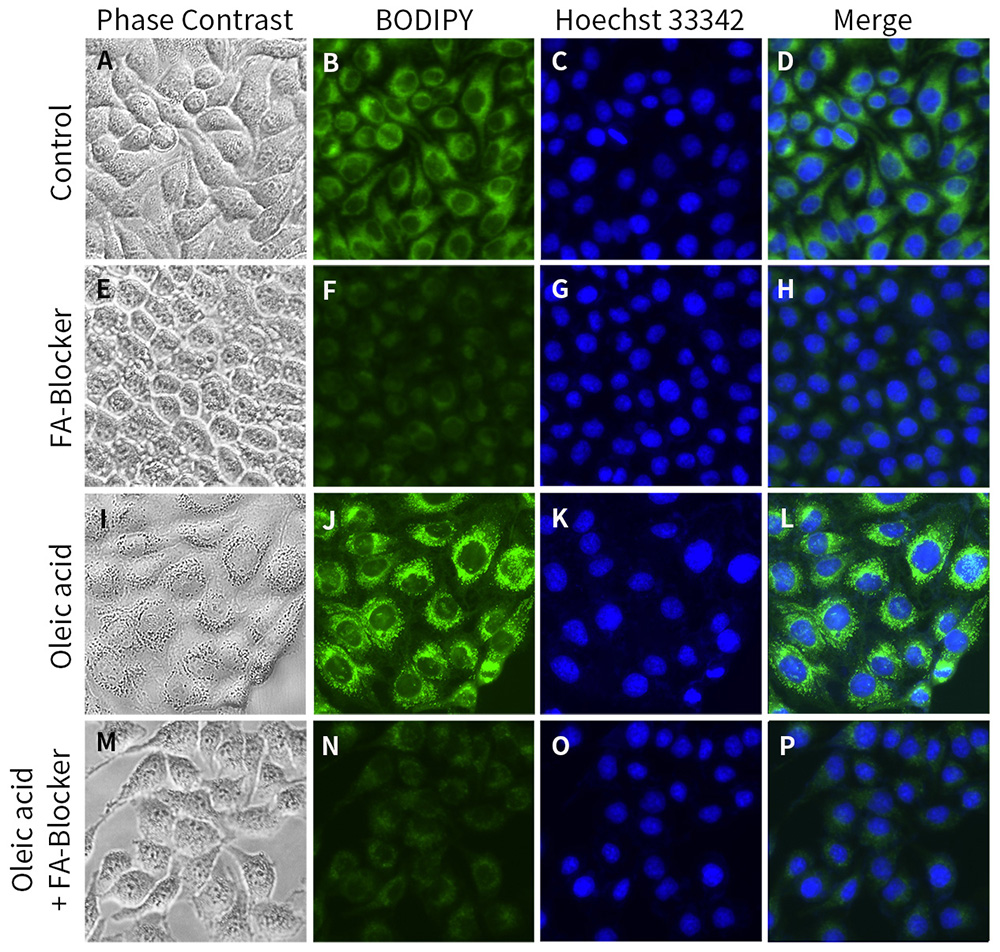
图2.碧云天脂肪酸摄取荧光检测试剂盒(绿色荧光标记月桂酸) (S0576)对HeLa细胞染色的效果图。图A为正常HeLa细胞在明场状态下的形态;图B为本试剂盒中BODIPY标记月桂酸摄入后的正常细胞,且正常细胞内无明显的脂滴凝聚现象;使用FA-Blocker处理抑制细胞的脂肪酸摄取,荧光强度出现明显减弱(图F);使用油酸(Oleic acid)处理细胞,荧光强度显著增强,细胞内出现脂滴聚集(图J),而在油酸处理时同时加入FA-Blocker同样也可抑制脂肪酸摄取(图N)。细胞核使用Hoechst 33342染色。实际染色效果会因实验条件、检测仪器等的不同而存在差异,图中效果仅供参考。
脂类(Lipid),又称脂质,是一类不溶于水而能溶于乙醇、乙醚、氯仿、苯等非极性有机溶剂的化合物。脂类是人体重要的宏量营养素之一,其主要生理功能包括储存和供给能量、提供机体必需脂肪酸、构成细胞膜等膜性细胞组分、以及参与细胞的信号转导等。脂类是脂肪酸与醇脱水缩合生成的酯及其衍生物,动物体内主要包括脂肪(Fats)、磷脂(Phospholipids)和类固醇(Steroids)等。脂质加工和运输缺陷是许多代谢性疾病的基础,脂质代谢异常也是导致肥胖、糖尿病、心血管疾病和癌变的主要因素。通过标记不同链长的脂肪酸,可视化脂肪酸的运输和代谢,可以更好地了解代谢功能[1]。BODIPY标记月桂酸常作为荧光探针用于脂肪酸摄取、脂质转运的研究,例如可以溶解在橄榄油中用于小鼠等检测肠道对于脂肪酸的吸收,检测脂肪、肝脏等对于灌胃后脂肪酸的吸收情况,研究血管平滑肌中脂质运输情况,以判断脂毒性在动脉粥样硬化发展中的作用等[2]。
对于96孔板中的样品,按照每孔使用100μl脂肪酸摄取工作液计算,本试剂盒的小包装和中包装可以进行1000次和5000次检测;对于6孔板中的贴壁培养细胞样品,按照每孔使用1ml脂肪酸摄取工作液计算,本试剂盒的小包装和中包装可以进行100次和500次检测;如果用于流式细胞仪检测,按照每个样品的检测体系体积为0.5ml时,本试剂盒的小包装和中包装可以进行200次和1000次检测。
包装清单:| 产品编号 | 产品名称 | 包装 |
| S0576S-1 | BODIPY-labeled Lauric Acid (1000X) | 100μl |
| S0576S-2 | Hoechst 33342 (1000X) | 100μl |
| S0576S-3 | FA-Blocker (1000X) | 20μl |
| S0576S-4 | Assay Buffer | 100ml |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| S0576M-1 | BODIPY-labeled Lauric Acid (1000X) | 500μl |
| S0576M-2 | Hoechst 33342 (1000X) | 500μl |
| S0576M-3 | FA-Blocker (1000X) | 100μl |
| S0576M-4 | Assay Buffer | 500ml |
| — | 说明书 | 1份 |
-20ºC保存,至少一年有效。其中BODIPY-labeled Lauric Acid (1000X)和Hoechst 33342 (1000X)须避光保存。
注意事项:BODIPY-labeled Lauric Acid (1000X)反复冻融可能对于其检测效果有影响,请适当分装,避免反复冻融。荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
对于微量的液体,每次使用前先离心数秒钟,使液体充分沉降到管底。
本产品应在无菌环境中使用,否则可能会影响检测结果。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| Samples | 1 | 10 | 50 | 200 |
| BODIPY-labeled Lauric Acid (1000X) | 0.1μl | 1μl | 5μl | 20μl |
| Hoechst 33342 (1000X) | 0.1μl | 1μl | 5μl | 20μl |
| Assay Buffer | 99.8μl | 998μl | 4.99ml | 19.96ml |
| Working Solution | 100μl | 1ml | 5ml | 20ml |
| 产品编号 | 产品名称 | 包装 |
| C0157 | 油红O染色试剂盒 | 50-250次/200-1000次 |
| C0158 | 改良油红O染色试剂盒 | 50-250次/200-1000次 |
| C2050 | 脂滴红色荧光检测试剂盒(LD540) | 100-1000次/500-5000次 |
| C2051 | 脂滴红色荧光检测试剂盒(Nile Red) | 100-1000次/500-5000次 |
| C2052 | 脂滴蓝色荧光检测试剂盒(LipiD-Blue) | 100-1000次/500-5000次 |
| C2053 | 脂滴绿色荧光检测试剂盒(BODIPY 493/503) | 100-1000次/500-5000次 |
| C2054 | 脂滴绿色荧光检测试剂盒(LipiD-Green) | 100-1000次/500-5000次 |
| C2055 | BODIPY 500/510 C1, C12 (脂肪酸绿色荧光探针) | 1mg/5mg/25mg |
| C2061 | 脂滴蓝色荧光探针(LipiD-Blue) | 0.1ml/0.5ml |
| S0576 | 脂肪酸摄取荧光检测试剂盒(绿色荧光标记月桂酸) | 100-1000次/500-5000次 |
| ST2053 | 油酸(≥99%, Cell Culture Grade) | 100μl/500μl/2ml |