碧云天的植物基因组DNA小量抽提试剂盒(离心柱式) (Plant Genomic DNA Purification Mini Spin Kit)是一种能从不同植物物种和组织类型中快速、高效地小量提取基因组DNA的试剂盒。本试剂盒采用离心柱方式提取DNA,无需使用有毒的苯酚-氯仿提取或耗时的酒精沉淀,更安全且节约时间,适用于不同植物的根、茎、叶片和芽等部位的基因组DNA提取。
本试剂盒具有稳定、高效、安全、便捷的优点。植物样品在液氮研磨后与裂解液孵育,或在裂解液中进行研磨,然后离心取上清溶液加入到纯化柱内。通过高速离心,使DNA在穿过纯化柱的瞬间,结合到纯化柱上,随后通过两次洗涤去除各种杂质,最后通过洗脱液把DNA洗脱下来。整个过程无需酚氯仿抽提,无需酒精沉淀,样品裂解后仅需约30分钟即可获得植物基因组DNA。
对于多糖多酚含量较高的植物样品或想要获得高纯度、高质量的基因组DNA的植物样品,推荐使用碧云天的多糖多酚植物基因组DNA小量抽提试剂盒(离心柱式) (D0046)。
通过本试剂盒获得的植物基因组DNA,OD260/OD280的范围通常在1.7至1.9之间。
本试剂盒可以从20-100mg植物样品中抽提获得约1-10μg的基因组DNA,可以根据植物材料不同调整起始重量,使用的样品过多,反而会影响抽提效果。对于比较珍贵或质量非常少的样品,使用20mg新鲜植物样品也可以获得比较理想的抽提效果。纯化后获得的DNA可用于后续多种分子生物学实验,如PCR、酶切、文库构建和Southern blot等。
本试剂盒的标准操作步骤抽提得到的植物基因组DNA会含有少量RNA,但如果按照可选步骤加入RNase A,就可以获得不含RNA的高纯度DNA。含有RNA的DNA可以用于PCR,但对于某些其它的后续反应可能会产生一些影响。
使用本试剂盒提取不同物种植物叶片的基因组DNA效果请参考图1。
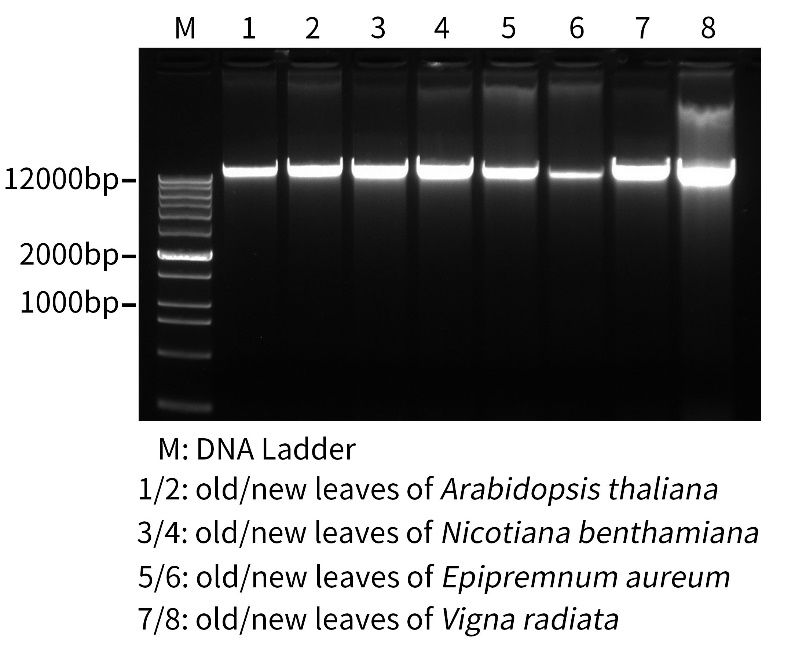
图1.碧云天植物基因组DNA小量抽提试剂盒(离心柱式) (D0045)提取不同植物新老叶片的基因组DNA效果图。采集100mg四种植物的新叶和老叶叶片加入液氮进行充分研磨后将样品恢复室温,先后加入500μl裂解液A和500μl裂解液B,混匀后65ºC水浴孵育裂解20分钟后,室温离心取上清溶液转移至纯化柱进行结合、洗涤和洗脱,洗脱体积均为100μl,最后进行1%琼脂糖凝胶电泳和核酸染色和荧光成像分析。电泳结果如图所示,不同物种植物新老叶片提取的基因组DNA的浓度和质量都较高。经过定量分析,100mg植物叶片样品最终纯化获得的基因组DNA含量分别约为:拟南芥(Arabidopsis thaliana)老叶2.3μg/新叶2.8μg、烟草(Nicotiana benthamiana)老叶3.7μg/新叶3.8μg、绿萝(Epipremnum aureum)老叶2.9μg/新叶2μg、绿豆(Vigna radiata)老叶4μg/新叶4.8μg。M, DNA marker:DNA Ladder (0.2-12 kb, 12 bands) (D0110)。实际检测效果会因实验条件、检测仪器等的不同而存在差异,图片数据仅供参考。
纯化柱对于DNA的最大结合容量约为30μg。
本试剂盒小包装和中包装分别可以抽提50个和200个植物样品的基因组DNA。
包装清单:| 产品编号 | 产品名称 | 包装 |
| D0045S-1 | 样品裂解液A | 28ml |
| D0045S-2 | 样品裂解液B | 28ml |
| D0045S-3 | 洗涤液I (第一次使用前加入7ml无水乙醇) | 21ml |
| D0045S-4 | 洗涤液II (第一次使用前加入45ml无水乙醇) | 30ml |
| D0045S-5 | 洗脱液 | 15ml |
| D0045S-6 | DNA纯化柱及废液收集管 | 50套 |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| D0045M-1 | 样品裂解液A | 110ml |
| D0045M-2 | 样品裂解液B | 110ml |
| D0045M-3 | 洗涤液I (第一次使用前加入28ml无水乙醇) | 84ml |
| D0045M-4 | 洗涤液II (第一次使用前加入180ml无水乙醇) | 120ml |
| D0045M-5 | 洗脱液 | 60ml |
| D0045M-6 | DNA纯化柱及废液收集管 | 200套 |
| — | 说明书 | 1份 |
室温保存,一年有效。
注意事项:尽可能使用新鲜的植物样品,以确保提取获得完整的、质量较高的基因组DNA。
如需制备不含RNA的高纯度基因组DNA,需自备RNase A,推荐选购碧云天RNase A (ST576/ST577)。
温度较低时样品裂解液A和样品裂解液B中可能会有沉淀产生,属正常现象。使用前必须检查一遍。如有沉淀,55ºC水浴孵育使沉淀溶解,混匀后使用。
第一次使用前洗涤液I需添加7ml/28ml无水乙醇,洗涤液II需添加45ml/180ml无水乙醇,混匀,并在瓶上做好标记。
本试剂盒需配合使用水浴锅或金属浴仪、电动研磨仪/研钵、研磨棒、涡旋振荡器、高速离心机,请提前作好准备。
请小心使用液氮,防止被液氮冻伤。样品从液氮中取出时,应立即打开管盖防止温差造成的离心管炸裂,同时液氮研磨样品时需不断添加液氮。推荐使用TissueMaster™高通量组织研磨仪(1.5/2ml×48) (E6618),以避免使用液氮。
除特别说明外,每次Vortex应控制在15秒内。
本试剂盒所有操作均在室温进行,操作时无需冰浴。所有离心也均在室温进行。
废液收集管在一次抽提中需多次使用,切勿中途丢弃。
洗脱离心柱膜内的DNA时,可以将洗脱液加热至65ºC,能够提高植物基因组DNA的洗脱效率[1]。
洗涤液I、洗涤液II对人体有害或有刺激性,操作时请小心,并注意有效防护以避免直接接触人体或吸入体内。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
| 产品编号 | 产品名称 | 包装 |
| D0045 | 植物基因组DNA小量抽提试剂盒(离心柱式) | 50次/200次 |
| D0046 | 多糖多酚植物基因组DNA小量抽提试剂盒(离心柱式) | 50次/200次 |
| D0047 | BeyoMag™植物基因组DNA小量抽提试剂盒(磁珠法) | 50次/200次 |
| D0063 | 基因组DNA小量抽提试剂盒(通用型, 离心柱式) | 50次 |
| D0088S | BeyoMag™基因组DNA小量抽提试剂盒(通用型, 磁珠法) | 50次 |
| D7292 | BeyoPlant™植物基因型快速鉴定试剂盒 | 100次/500次 |
| ST576 | RNase A (10mg/ml, DNase free) | 1ml |
| ST577 | RNase A (100mg/ml, DNase free) | 0.5ml |
| ST578 | RNase A (10mg/ml) | 1ml |
| ST579 | RNase A (100mg/ml) | 0.5ml |
| ST725 | TE (Tris-EDTA缓冲液) | 100ml |
| F6621 | 金属研磨珠(3mm) | 500个/包装 |
| F6623 | 金属研磨珠(5mm) | 500个/包装 |
| F6632 | 陶瓷研磨珠(3mm) | 500个/包装 |
| F6635 | 陶瓷研磨珠(5mm) | 500个/包装 |
| F6646-1bag | 研磨仪专用离心管(加厚型, 2ml) | 500个/包 |
| FS003 | 普通剪刀(12.5cm, 直尖) | 1把/袋 |
| FS019 | 普通镊子(12.5cm, 直圆头) | 1把/袋 |
| FS027 | 精细镊(11cm, 直) | 1把/袋 |
| E6600 | TissueMaster™手持式组织研磨仪 | 1套 |
| E6606 | TissueMaster™一次性塑料研磨杵 | 20pcs/100pcs |
| E6618 | TissueMaster™高通量组织研磨仪(1.5/2ml×48) | 1台 |
| E1644 | 高通量组织研磨器(夹具行程32mm) | 1台 |
| E1643 | 高通量组织研磨器(夹具行程34mm) | 1台 |