|
|||||||||
产品简介
产品简介:
| 产品编号 | 产品名称 | 产品包装 | 产品价格 |
| RG028 | 双萤光素酶报告基因检测试剂盒 | 1000次 | 4699.00元 |
碧云天生产的双萤光素酶报告基因检测试剂盒(Dual Luciferase Reporter Gene Assay Kit),是先以萤光素(luciferin)为底物来检测萤火虫萤光素酶(Firefly luciferase),后以肠腔素(coelenterazine)为底物来检测海肾萤光素酶(Renilla luciferase),并且在后续加入海肾萤光素酶底物时,同时加入抑制萤火虫荧光素酶催化luciferin发光的物质,使后续检测仅仅检测到海肾萤光素酶的活性,实现双萤光素酶报告基因检测。
萤火虫萤光素酶是一种分子量约为61kD的蛋白,在ATP、镁离子和氧气存在的条件下,可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出生物萤光(bioluminescence)。海肾萤光素酶是一种分子量约为36kD的蛋白,在氧气存在的条件下,可以催化coelenterazine氧化成coelenteramide,在coelenterazine氧化的过程中也会发出生物萤光。生物萤光可以通过化学发光仪(luminometer)或液闪测定仪进行测定。本试剂盒的检测原理参考图1。
![]()
![]()
图1. 双萤光素酶的检测原理图。
通过萤光素酶和其底物这一生物发光体系,可以非常灵敏、高效地检测基因的表达。通常把感兴趣
基因的转录调控元件或5’启动子区克隆在luciferase的上游,或把3’-UTR区克隆在luciferase的下游等,构建成报告基因(reporter gene)质粒。然后转染细胞,用适当药物等处理细胞后裂解细胞,测定萤光素酶活性。通过萤光素酶活性的高低来判断药物处理等对目的基因的转录调控作用。Renilla luciferase相对更多地被用作转染效率的内参,以消除细胞数量和转染效率的差异。
萤火虫萤光素酶催化luciferin发光的最强发光波长为560nm。海肾萤光素酶催化coelenterazine发
光的最强发光波长为465nm。
本试剂盒可以测定1000个样品。
包装清单:
产品编号 |
产品名称 |
包装 |
RG028-1 |
报告基因细胞裂解液 |
RG027-1×10 |
RG028-2 |
萤火虫萤光素酶检测试剂 |
RG027-2×10 |
RG028-3 |
海肾萤光素酶检测缓冲液 |
RG027-3×10 |
RG028-4 |
海肾萤光素酶检测底物(100×) |
RG027-4×10 |
— |
说明书 |
1份 |
保存条件:
报告基因细胞裂解液和海肾萤光素酶检测缓冲液在4℃保存1个月有效,-20℃保存一年有效,-80℃可以长期保存;萤光素酶检测试剂和 海肾萤光素酶检测底物(100×)在-20℃避光保存6个月有效,-80℃避光保存一年有效。
注意事项:
加入海肾萤光素酶检测工作液后对于上一步骤中的萤火虫萤光素酶的抑制可以达到99%以上。但总会残留微量活性,因此,宜在转染时把海肾萤光素酶的表达量控制在其RLU读数高于萤火虫萤光素酶RLU读数的10%。海肾萤光素酶的读数高于萤火虫萤光素酶的读数是完全可以的,通常不会有明显的负面影响。
为取得最佳测定效果,在用单管的化学发光仪测定时,样品和测定试剂混合后到测定前的时间应尽量控制在相同的时间内,例如30秒内;使用具有化学发光测定功能的多功能荧光酶标仪时,宜先把样品全部加好,然后统一加入萤火虫萤光素酶检测试剂。
由于温度对酶反应有影响,所以测定时样品和试剂均需达到室温后再进行测定。
为保证萤光素酶检测试剂的稳定性,可以采取适当分装后避光保存的方法,以避免反复冻融和长时
间暴露于室温。经测试,反复冻融三次,对测定结果无明显影响。
样品和测定试剂混合后,必须等待1-2秒,再进行测定。测定时间通常为10秒,根据情况也可以测定更长或更短时间,但是同一批样品宜使用相同的测定时间。
RG027-4 海肾萤光素酶检测底物(100×)配制在无水乙醇中。由于无水乙醇容易挥发,有时会在初次使用时发现体积明显小于100μl的情况,此时用无水乙醇把体积补足至100μl,并混匀后即可使用。
海肾萤光素酶检测工作液宜配制后立即使用。如不能立即使用,-20℃可以保存一周。随着保存时间的延长检测效果会不断下降,因此不可配制成工作液后长期保存。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明
使用说明:
1. 裂解细胞:将报告基因细胞裂解液充分混匀后,按如下方式加入报告基因细胞裂解液,充分裂解细
胞。
a. 对于贴壁细胞:吸尽细胞培养液后,参考下表加入适量的报告基因细胞裂解液;对于悬浮细胞:
离心去上清后,参考下表加入适量报告基因细胞裂解液。
器皿类型 |
96孔板 |
48孔板 |
24孔板 |
12孔板 |
6孔板 |
报告基因细胞裂解液(微升/孔) |
100 |
150 |
200 |
300 |
500 |
注:如果萤光素酶的表达水平比较低,可以尝试使用更少的裂解液,例如6孔板的每孔用量可以最小
为100微升。
b. 充分裂解后,10,000-15,000g离心3-5分钟,取上清用于测定。
注:细胞裂解后可以立即测定萤光素酶,也可以先冻存,待以后再测定。冻存样品需融解,并达到室
温后再进行测定。
2. 融解萤火虫萤光素酶检测试剂和海肾萤光素酶检测缓冲液,并达到室温。海肾萤光素酶检测底物
(100×)置于冰浴或冰盒上备用。
3. 按照每个样品需100微升的量,取适量海肾萤光素酶检测缓冲液,按照1:100加入海肾萤光素酶检测底
物(100×) 配制成海肾萤光素酶检测工作液。例如,1毫升海肾萤光素酶检测缓冲液中加入10微升海
肾萤光素酶检测底物(100×)充分混匀后即可配制成约1毫升海肾萤光素酶检测工作液。
4. 按仪器操作说明书开启化学发光仪或具有检测化学发光功能的多功能酶标仪,将测定间隔设为2秒,
测定时间设为10秒。
5. 每个样品测定时,取样品20-100微升(如果样品量足够,请加入100微升;如果样品量不足可以适当减
少用量,但同批样品的使用量宜保持一致)。
6. 加入100微升萤火虫萤光素酶检测试剂,用枪打匀或用其它适当方式混匀后测定RLU(relative light
unit)。以报告基因细胞裂解液为空白对照。
7. 在完成上述测定萤火虫萤光素酶步骤后,加入100微升海肾萤光素酶检测工作液,用枪打匀或用其它
适当方式混匀后测定RLU(relative light unit)。本试剂盒的检测效果可以参考图2。
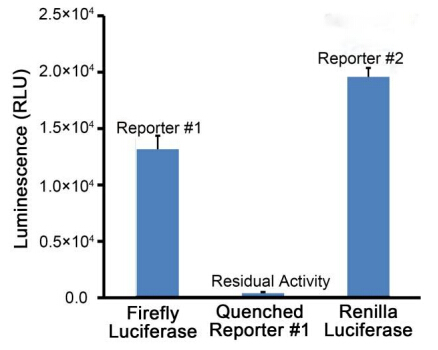
图2. 本试剂盒的检测效果。实际读数会因细胞数量、转染效果、检测仪器等的不同而存在差异,图中数据仅供参考。
8. 在以海肾萤光素酶为内参的情况下,用萤火虫萤光素酶测定得到的RLU值除以海肾萤光素酶测定得到
的RLU值。根据得到的比值来比较不同样品间目的报告基因的激活程度。如果以萤火虫萤光素酶为内
参,也可以进行类似计算。
常见问题:
1. Luminometer和荧光分光光度计有何不同?
荧光分光光度计检测的样品本身不能发光,样品需要由特定波长的激发光激发,然后才能产生荧光
并被荧光分光光度计检测。Luminometer检测的样品本身可以发光,不需要激发光进行激发。也就是
说luminometer是检测化学发光(萤光)的仪器。有些型号的荧光分光光度计也具有luminometer的功
能,即也可以检测化学发光。您所使用的荧光分光光度计能否用于化学发光的测定请仔细阅读该仪
器的说明书。
2. 可以进行ATP化学发光检测的仪器是否就可以用于本试剂盒的检测?
是。ATP化学发光的检测原理和本试剂盒的原理相同,可以用相同的仪器测定。
相关产品:
产品编号 |
产品名称 |
包装 |
RG005 |
100次 |
|
RG006 |
1000次 |
|
RG016 |
100次 |
|
RG017 |
1000次 |
|
RG027 |
100次 |
|
RG028 |
1000次 |
|
RG0036 |
200次 |
产品图片
相关产品
相关论文
使用本产品的文献:
1. Zhou F, Zhang L, Gong K, Lu G, Sheng B, Wang A, Zhao N, Zhang X, Gong Y.
LEF-1 activates the transcription of E2F1.
Biochem Biophys Res Commun. 2008 Jan 4;365(1):149-53. Epub 2007 Oct 31.
2. Rong JJ, Hu R, Qi Q, Gu HY, Zhao Q, Wang J, Mu R, You QD, Guo QL.
Gambogic acid down-regulates MDM2 oncogene and induces p21(Waf1/CIP1) expression
independent of p53.
Cancer Lett. 2009 Oct 18;284(1):102-12. Epub 2009 May 9.
3. Yuan D, Pan Y, Zhang J, Shao C.
Role of nuclear factor-kappaB and P53 in radioadaptive response in Chang live cells.
Mutat Res. 2010 Jun 1;688(1-2):66-71. Epub 2010 Mar 20.
4. Zhang J, Chen Y, Xin XL, Li QN, Li M, Lin LP, Geng MY, Ding J.
Oligomannurarate sulfate blocks tumor growth by inhibiting NF-kappaB activation.
Acta Pharmacol Sin. 2010 Mar;31(3):375-81. Epub 2010 Feb 15.
5. Zhou ZL, Luo ZG, Yu B, Jiang Y, Chen Y, Feng JM, Dai M, Tong LJ, Li Z, Li YC, Ding J,
Miao ZH.
Increased accumulation of hypoxia-inducible factor-1α with reduced transcriptional
activity mediates the antitumor effect of triptolide.
Mol Cancer. 2010 Oct 11;9:268.
6. Jiang ZJ, Jin TT, Gao F, Liu JW, Zhong JJ, Zhao H.
Effects of Ganoderic acid Me on inhibiting multidrug resistance and inducing apoptosis
in multidrug resistant colon cancer cells.
Process Biochemistry,46(6),2011 Jun,1307-1314.
7. Xu Y, Jiang Z, Yin P, Li Q, Liu J.
Role for Class I histone deacetylases in multidrug resistance.
Exp Cell Res. 2012 Feb 1;318(3):177-86.
8. Feng N, Xu B, Tao J, Li P, Cheng G, Min Z, Mi Y, Wang M, Tong N, Tang J, Zhang Z,
Wu H, Zhang W, Wang Z, Hua L.
A miR-125b binding site polymorphism in bone morphogenetic protein membrane receptor
type IBgene and prostate cancer risk in China.
Mol Biol Rep. 2012 Jan;39(1):369-73.
9. Zhang J, Xin X, Chen Q, Xie Z, Gui M, Chen Y, Lin L, Feng J, Li Q, Ding J, Geng M.
Oligomannurarate sulfate sensitizes cancer cells to doxorubicin by inhibiting atypical
activation of NF-κB via targeting of Mre11.
Int J Cancer. 2012 Jan 15;130(2):467-77.
10. Guo L, Wu WJ, Liu LD, Wang LC, Zhang Y, Wu LQ, Guan Y, Li QH.
Herpes simplex virus 1 ICP22 inhibits the transcription of viral gene promoters by
binding to and blocking therecruitment of P-TEFb.
PLoS One. 2012;7(9):e45749. doi: 10.1371/journal.pone.0045749. Epub 2012 Sep 24.
11. Zhou H, Chen S, Wang W, Wang Z, Wu X, Zhang Z.
Nanog inhibits lipopolysaccharide-induced expression of pro-inflammatory cytokines by
blocking NF-κBtranscriptional activity in rat primary microglial cells.
Mol Med Rep. 2012 Mar;5(3):842-6. doi: 10.3892/mmr.2011.719. Epub 2011 Dec 19.
12. Zhou Z, Wang M, Zhao J, Wang L, Gao Y, Zhang H, Liu R, Song L.
The increased transcriptional response and translocation of a Rel/NF-κB homologue in
scallop Chlamys farreriduring the immune stimulation.
Fish Shellfish Immunol. 2013 May;34(5):1209-15. doi: 10.1016/j.fsi.2013.01.009.
Epub 2013 Feb 9.
13. Deng X, Rui W, Zhang F, Ding W.
PM2.5 induces Nrf2-mediated defense mechanisms against oxidative stress by activating
PIK3/AKT signalingpathway in human lung alveolar epithelial A549 cells.
Cell Biol Toxicol. 2013 Jun;29(3):143-57. doi: 10.1007/s10565-013-9242-5.
Epub 2013 Mar 24.
14. Song S, Zhou F, Chen WR, Xing D.
PDT-induced HSP70 externalization up-regulates NO production via TLR2 signal pathway in
macrophages.
FEBS Lett. 2013 Jan 16;587(2):128-35. doi: 10.1016/j.febslet.2012.11.026.
Epub 2012 Dec 14.
15.Zeng W, Chang H, Ma M, Li Y.
CCL20/CCR6 promotes the invasion and migration of thyroid cancer cells via NF-kappa B
signaling-induced MMP-3 production.
Exp Mol Pathol. 2014 Aug;97(1):184-90. doi: 10.1016/j.yexmp.2014.06.012. Epub 2014
Jun 28.
16.Gao F, Wang W.
MicroRNA-96 promotes the proliferation of colorectal cancer cells and targets tumor
protein p53 inducible nuclear protein 1, forkhead box protein O1 (FOXO1) and FOXO3a.
Mol Med Rep. 2014 Nov 4. doi: 10.3892/mmr.2014.2854.
苏ICP备06009238号 |
