总抗氧化能力检测试剂盒(ABTS快速法),即Total Antioxidant Capacity Assay Kit with a Rapid ABTS method,简称T-AOC Assay Kit,是一种采用2,2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid(ABTS)作为显色剂,可以对血浆、血清、唾液、尿液等各种体液,细胞或组织等裂解液、植物或中草药抽提液、或各种抗氧化物(antioxidant)溶液的总抗氧化能力进行快速检测的试剂盒。
活性氧(Reactive oxygen species, ROS)主要包括羟基自由基、超氧自由基和过氧化氢。在细胞或组织的正常生理代谢过程中会产生活性氧,同时一些环境因子例如紫外照射、γ射线照射、吸烟、环境污染等也可以诱导活性氧的产生。活性氧产生后,可以导致细胞内脂、蛋白和DNA等的氧化损伤,诱发氧化应激(Oxidative stress),继而导致各种肿瘤、动脉粥样硬化、风湿性关节炎、糖尿病、肝损伤、以及中枢神经系统疾病等。
机体中存在多种抗氧化物,包括抗氧化大分子、抗氧化小分子和酶等,可以清除体内产生的各种活性氧,以阻止活性氧诱导的氧化应激(oxidative stress)的产生。一个体系内的各种抗氧化大分子、抗氧化小分子和酶的总的水平即体现了该体系内的总抗氧化能力。因此测定血浆、血清、尿液、唾液等各种体液,细胞或组织等裂解液中的总抗氧化能力具有非常重要的生物学意义。
植物或中草药抽提液、或各种抗氧化物溶液的总抗氧化能力的检测可以用于检测各种溶液的抗氧化能力的强弱,可以用于筛选强抗氧化能力的药物。
ABTS法测定总抗氧化能力的原理参考图1,ABTS在适当的氧化剂作用下氧化成绿色的ABTS˙+,在抗氧化物存在时ABTS˙+的产生会被抑制,在414nm或734nm测定ABTS˙+的吸光度即可测定并计算出样品的总抗氧化能力。Trolox是一种维生素E的类似物,具有和维生素E相近的抗氧化能力,用作其它抗氧化物总抗氧化能力的参考。例如,Trolox的总抗氧化能力为1,相同浓度情况下,其它物质的抗氧化能力用其抗氧化能力和Trolox相比的倍数来表示。

图1.ABTS法检测总抗氧化能力的原理图。
本试剂盒方便快捷,加入待测样品后6分钟即可进行吸光度测定,通常10-20个样品可以在十多分钟内检测完毕。
本试剂盒可以检测100个样品。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| S0121-1 | 检测缓冲液 | 20ml |
| S0121-2 | ABTS溶液 | 1ml |
| S0121-3 | 过氧化氢溶液 | 0.5ml |
| S0121-4 | 过氧化物酶 | 0.2ml |
| S0121-5 | Trolox溶液(10mM) | 0.1ml |
| — | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。其中S0121-2 ABTS溶液和S0121-5 Trolox溶液(10mM)需避光保存。
注意事项:
样品中不能添加DTT、巯基乙醇等影响氧化还原反应的物质,也不宜添加Tween、Triton和NP-40等去垢剂。
测定时需可以测定A414的酶标仪一台(测405-425nm也可以)或可以测定微量样品的分光光度计一台。
如果检测时标准品浓度为零时的吸光度值偏低(例如低于1.5),提示过氧化氢可能部分降解,此时可以考虑把过氧化氢的稀释倍数调整为500倍或更低的倍数。
ABTS对人体有刺激性,操作时请小心,并注意适当防护以避免直接接触人体或吸入体内。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.过氧化氢溶液和过氧化物酶的稀释,以及ABTS工作液的配制:
a.用双蒸水把过氧化氢溶液稀释1000倍。例如取10微升过氧化氢溶解,加入到9.99ml双蒸水中,混匀即为1/1000 过氧化氢溶液。
b.根据待测样品的数量,取适量过氧化物酶用检测缓冲液稀释10倍。例如取20微升过氧化物酶,加入到180微升检测缓冲液中,混匀后即可配制成200微升过氧化物酶工作液。过氧化物酶工作液宜新鲜配制使用。
c.参考下表,根据待测定样品的数量(含标准曲线)配制适量的ABTS工作液:
| 1个检测 | 5个检测 | 10个检测 | 20个检测 | |
| 检测缓冲液 | 152微升 | 760微升 | 1520微升 | 3040微升 |
| ABTS溶液 | 10微升 | 50微升 | 100微升 | 200微升 |
| 1/1000 过氧化氢溶液 | 8微升 | 40微升 | 80微升 | 160微升 |
| ABTS工作液 | 170微升 | 850微升 | 1700微升 | 3400微升 |
注意:ABTS工作液配制后,室温避光保存,宜在30分钟内使用完毕。如果检测时标准品浓度为零时的吸光度值偏低,提示过氧化氢可能部分降解,此时可以考虑把过氧化氢的稀释倍数调整为500倍或更低的倍数。
2.待测样品的准备:
a.血清、血浆、唾液或尿液样品的准备:
血清、血浆、唾液或尿液样品每个样品需要10微升,都可以直接用于测定。血清、血浆、唾液或尿液样品都可以使用新鲜样品进行测定,也可以-80℃冻存后再进行测定。-80℃冻存的样品至少在一个月内所测定获得的数据没有显著变化。
注意:血浆制备时可以使用肝素或柠檬酸钠抗凝,不宜使用EDTA抗凝。根据文献报道,人血清或血浆中的总抗氧化能力为0.5-2mM,人唾液中的总抗氧化能力为0.3-1mM,人尿液中的总抗氧化能力为0.2-3mM。
b.细胞或组织样品的准备:
对于细胞样品,收集约100万个细胞(不必精确计数,直接刮下,不宜使用胰酶和EDTA消化),放置在200微升冰冷的PBS或HBSS溶液中,匀浆或超声以充分破碎细胞并释放其中的抗氧化物,4℃约12000g离心5分钟,取上清用于后续测定。对于组织样品,每20mg组织加入100微升冰冷的PBS或HBSS溶液,匀浆或超声以充分破碎组织并释放其中的抗氧化物,4℃约12000g离心5分钟,取上清用于后续测定。以上所有操作均需在4℃或冰上操作。制备好的细胞或组织样品的上清如果不立即用于测定,可以在-80℃冻存。-80℃冻存的样品至少在一个月内所测定获得的数据没有显著变化。细胞或组织样品在测定总抗氧化能力时需同时测定蛋白浓度,最后测定获得的总抗氧化能力通常表示为每毫克或每克蛋白重量中的总抗氧化能力,表示单位为mmol/mg或mmol/g。
c.其它样品的准备:
植物或中草药抽提液都可以直接用于检测。需注意样品本身的颜色不会干扰检测。植物或中草药抽提液的抗氧化能力可以表示为每毫克或每克抽提物干重中的总抗氧化能力,表示单位为mmol/mg或mmol/g。各种抗氧化物测定其抗氧化能力时,通常配制成0.15-1.5mM,然后进行测定。抗氧化物的浓度可以以摩尔浓度表示时,测定获得的总抗氧化能力可以用相对总抗氧化能力进行表示,例如0.5mM的某抗氧化物其测定获得的OD值和1mM的Trolox测定获得的OD值相同,则其相对总抗氧化能力为2,再如0.2mM的某抗氧化物其测定获得的OD值和1mM的Trolox测定获得的OD值相同,则其相对总抗氧化能力为5。根据文献报道,维生素C的抗氧化能力为1.0,维生素E的抗氧化能力为1.0,GSH的抗氧化能力为1.3,Uric acid的抗氧化能力为1.0,β-Carotene的抗氧化能力为2.6,Lycopene的抗氧化能力为3.1,Quercetin的抗氧化能力为3.0,鲜橙汁的总抗氧化能力为2.2。注:此处文献中的抗氧化能力数据仅供参考。
3.标准曲线测定的准备:
用蒸馏水或样品配制溶液稀释标准品。对于血清、血浆、唾液或尿液样品直接用蒸馏水或PBS稀释标准品,对于细胞或组织样品,用于细胞或组织匀浆的溶液稀释标准品,其它样品则用样品配制溶液对标准品进行稀释。把10mM Trolox标准溶液稀释成0.15、0.3、0.6、0.9、1.2和1.5mM。
4.总抗氧化能力的测定:
a.96孔板的每个检测孔中加入20微升过氧化物酶工作液。
b.空白对照孔中加入10微升蒸馏水或PBS等适当溶液;标准曲线检测孔内加入10微升各种浓度的Trolox标准溶液;样品检测孔内加入10微升各种样品。轻轻混匀。
c.每个孔内加入170微升ABTS工作液,轻轻混匀。
d.室温孵育6分钟后测定A414。如果测定A414有困难,也可以在405-425nm范围内进行测定。
e.计算标准品每个点的ΔA414:ΔA414=A414空白对照-A414标准品,用ΔA414和Trolox标准溶液浓度制作标准曲线图(如图2)。标准曲线可以用公式y=ax+b表示(y是ΔA414,x是Trolox标准溶液浓度,a是斜率,y是截距)。样品的ΔA414=A414空白对照-A414样品,根据标准曲线公式计算出样品相当于多少mM的Trolox标准品,即得出该样品的总抗氧化能力(可以参考图3)。如果样品测定出来的吸光度在标准曲线范围以外,例如空白对照是1.5,样品的ΔA414小于0.2或者大于1.4,此时需要将样品适当浓缩或稀释后再进行测定。
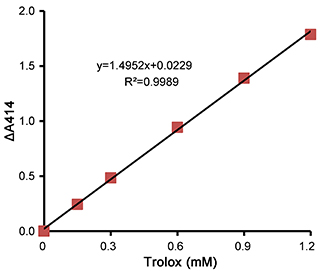 图2. 总抗氧化能力检测试剂盒(ABTS快速法)测定Trolox标准品的效果图。不同的检测条件下,实际读数会因标准品、检测仪器等的不同而存在差异,图中数据仅供参考。
图2. 总抗氧化能力检测试剂盒(ABTS快速法)测定Trolox标准品的效果图。不同的检测条件下,实际读数会因标准品、检测仪器等的不同而存在差异,图中数据仅供参考。
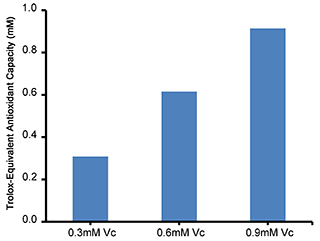 图3. 总抗氧化能力检测试剂盒(ABTS快速法)测定0.3mM、0.6mM、0.9mM的L-Ascorbic acid (Vc),计算Vc相应的ΔA414,然后根据标准曲线计算出相应浓度Vc的Trolox mM数。不同的检测条件下,实际读数会因标准品、检测仪器等的不同而存在差异,图中数据仅供参考。
图3. 总抗氧化能力检测试剂盒(ABTS快速法)测定0.3mM、0.6mM、0.9mM的L-Ascorbic acid (Vc),计算Vc相应的ΔA414,然后根据标准曲线计算出相应浓度Vc的Trolox mM数。不同的检测条件下,实际读数会因标准品、检测仪器等的不同而存在差异,图中数据仅供参考。
f.总抗氧化能力的表示方式:在采用Trolox作为标准品进行总抗氧化能力检测时,样品的抗氧化能力可以用Trolox-Equivalent Antioxidant Capacity (TEAC)来表示。对于混合物例如血浆、血清、唾液或尿液等的抗氧化能力,可以直接用Trolox的摩尔浓度来表示,例如某样品测定获得的ΔA414和0.6mM的Trolox相同,则该样品的总抗氧化能力为0.6mM;再如某样品稀释5倍后测定获得的ΔA414和0.5mM的Trolox相同,则该样品的总抗氧化能力为2.5mM。对于细胞或组织裂解液等,例如某裂解液样品的蛋白浓度为0.15mg/ml,测定获得的ΔA414和0.3mM Trolox相同,则该裂解液样品的总抗氧化能力为0.3mM/0.15mg/ml,即为2mmol/g。对于植物或中草药抽提物,例如某样品的浓度为0.1mg/ml,测定获得的ΔA414和0.5mM Trolox相同,则该样品的总抗氧化能力为0.5mM/0.1mg/ml,即为5mmol/g。对于纯的化合物例如维生素C、GSH等,例如使用1mM某样品检测时的ΔA414相当于1.5mM Trolox时,该样品的抗氧化能力为1.5mM,再如使用0.5mM某样品检测时的ΔA414相当于0.8mM Trolox时,该样品的抗氧化能力为1.6mM。图3中0.3mM、0.6mM、0.9mM的L-Ascorbic acid (Vc)这三个样品的总抗氧化能力分别为0.309mM、0.615mM、0.914mM,或者说L-Ascorbic acid (Vc)的抗氧化能力为1.024mM或1.024。