碧云天生产的Dual-Lumi™双萤光素酶报告基因检测试剂盒(Dual-Lumi™ Luciferase Reporter Gene Assay Kit,Dual-Lumi™ Luciferase Assay Kit),简称Dual-Lumi,是一种无需洗涤或收集细胞的用化学发光法先后直接测定细胞内萤火虫萤光素酶(firefly luciferase)和海肾萤光素酶(sea pansy (Renilla reniformis) luciferase,简称Renilla luciferase)的高灵敏度、高信号稳定性的双萤光素酶报告基因检测试剂盒。
本产品是Dual-Lumi™ II萤火虫萤光素酶报告基因检测试剂盒(简称Dual-Lumi II,产品编号为RG089)的不同包装版本,两者的检测效果完全一致。本产品,即Dual-Lumi中的Dual-Lumi™萤火虫萤光素酶检测试剂为即用型液体,其优点是无需配制即可以直接使用,但需要-80℃保存,如果在-20℃保存时间较长后检测效果会逐渐下降。Dual-Lumi™双萤光素酶报告基因检测试剂盒中的Dual-Lumi™ II萤火虫萤光素酶检测试剂,是冻干粉版本,优点是在-20℃保存非常稳定,缺点是使用前需要使用提供的缓冲液充分溶解底物冻干粉后才能使用。
本试剂盒提供的Dual-Lumi™萤火虫萤光素酶检测试剂和经配制的Dual-Lumi™海肾萤光素酶检测试剂,按照与培养液等体积的比例分别加入到细胞培养板内反应10分钟,即可进行两次化学发光检测。本试剂盒使用灵活便捷、检测灵敏度高、测定样品的线性范围宽,性能优于国外主要同类产品。另外,本产品也可以用于裂解并收集保存的细胞样品的检测。
本产品的性能优于国外主要同类产品。本产品的用途与Promega公司的Dual-Glo™ Luciferase Assay System (简称Dua-Glo)基本相同,但本产品的检测灵敏度显著优于国外同类产品(Competitor P),萤火虫萤光素酶的信号强度比同类产品(Competitor P)提高了约60% (图1A),海肾萤光素酶的信号强度比同类产品(Competitor P)提高了约50% (图1C);化学发光的信号稳定性与国外同类产品(Competitor P)基本一致(图1B, D)。本产品与国外同类产品(Competitor P)的检测效果比较参见图1。
本产品发光强度高。对于相同的细胞样品,对萤火虫萤光素酶的检测,本产品的发光效果比国外同类产品(Competitor P)强约40-80% (图1A),对海肾萤光素酶的检测,本产品的发光效果比国外同类产品(Competitor P)强约25-70% (图1C)。实测效果可能会因细胞种类、检测环境等的不同有所差异。
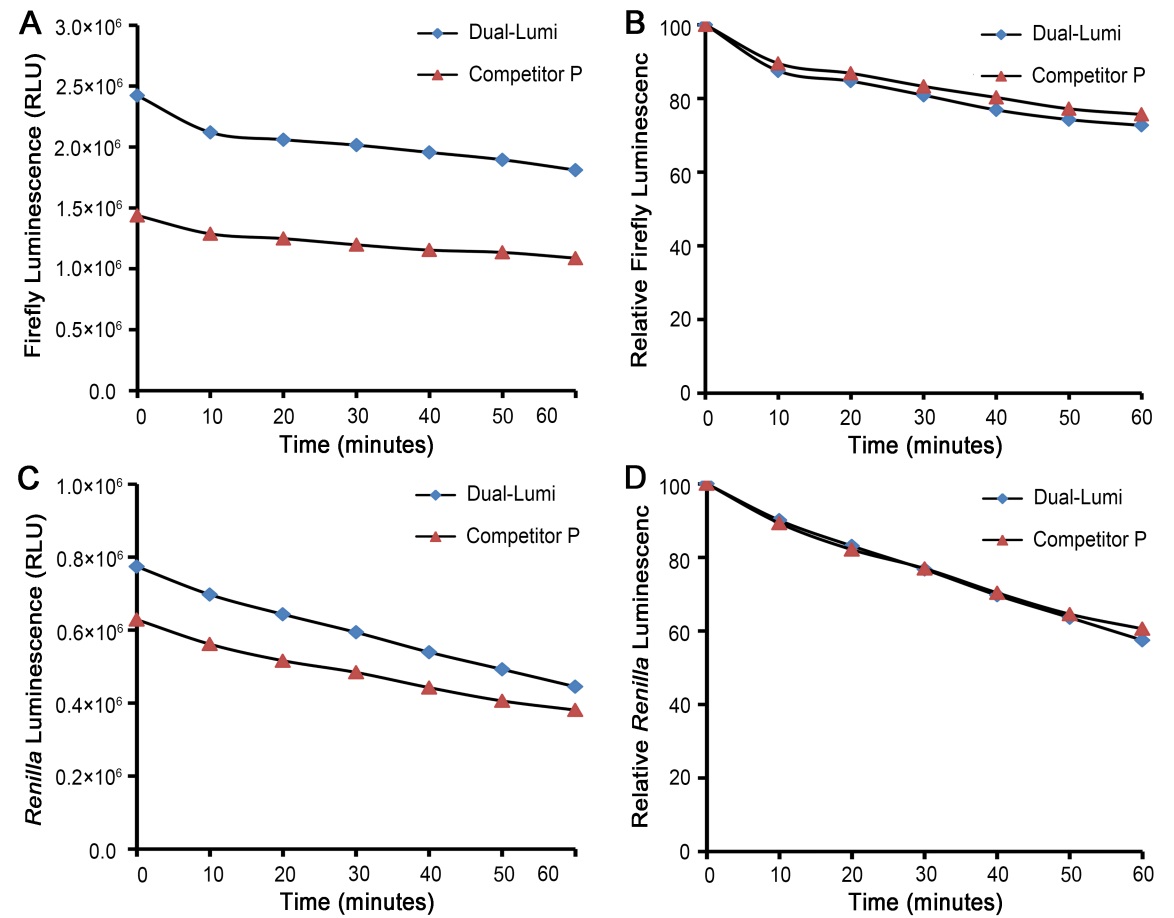
图1. Dual-Lumi™双萤光素酶报告基因检测试剂盒(Dual-Lumi)和国外同类产品(Competitor P)对共转染萤火虫萤光素酶报告基因质粒和海肾萤光素酶报告基因质粒的HeLa细胞的检测效果。图A和图B为Dual-Lumi和Competitor P对萤火虫萤光素酶的化学发光强度和化学发光稳定性的检测效果对比图,图C和图D为Dual-Lumi和Competitor P对海肾萤光素酶的化学发光强度和化学发光稳定性的检测效果对比图。实际读数会因细胞种类、报告基因质粒、检测仪器等的不同而存在差异,图中数据仅供参考。
本产品的检测灵敏度高,测定样品的线性范围宽。96孔板中,本产品通常可以在10万个细胞范围内呈现良好的线性关系。不同的细胞、不同的萤光素酶表达水平时的检测细胞数量的上限可能有所差异,当萤光素酶表达水平很高时,可能低于10万个细胞范围内有良好的线性关系,但是化学发光读数还是会随着细胞数量的增加而继续升高的。本产品对萤火虫萤光素酶报告基因质粒和海肾萤光素酶报告基因质粒共转染的不同数量的HeLa细胞的检测效果参见图2。
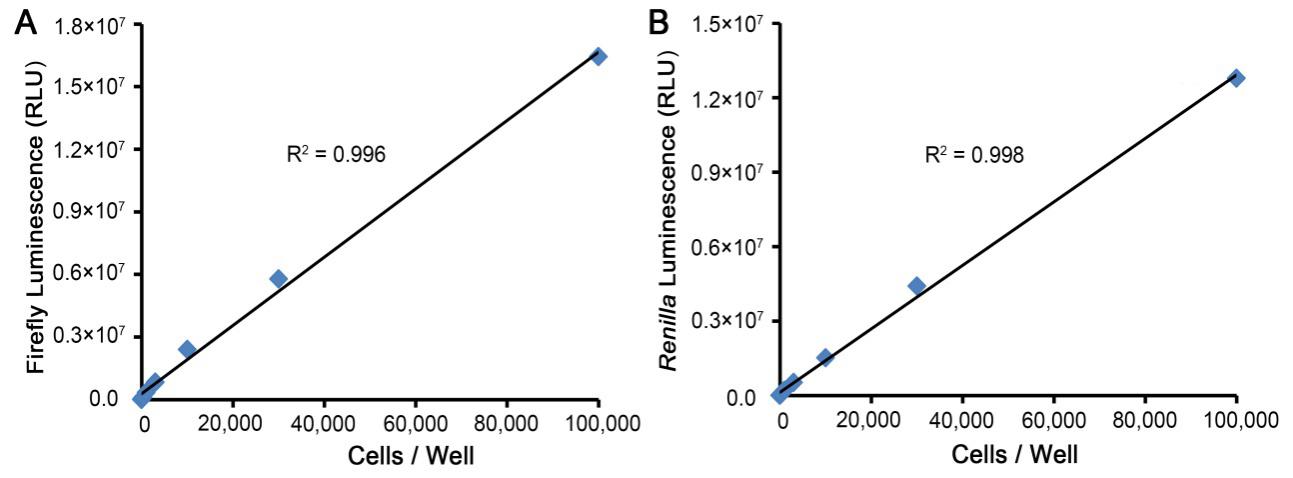
图2. 本产品对萤火虫萤光素酶报告基因质粒和海肾萤光素酶报告基因质粒共转染的不同数量的HeLa细胞的检测效果。根据共转的EGFP表达质粒,实测转染效率约为60-70%。实际读数会因细胞种类、转染效率、所用报告基因质粒、检测仪器等的不同而存在差异,图中数据仅供参考。
本产品操作简单,读数稳定,检测速度快,完成整个检测流程仅需约20分钟。本产品比其它双萤光素酶测定方法更加简单快捷,细胞可以在同一块多孔板中培养和检测,无需洗涤细胞,无需更换或去除培养液,也无需裂解和收集细胞样品,只需把试剂盒提供的Dual-Lumi™萤火虫萤光素酶检测试剂及Dual-Lumi™海肾萤光素酶检测底物和Dual-Lumi™海肾萤光素酶检测缓冲液按照1:100的比例混合配制成Dual-Lumi™海肾萤光素酶检测工作液,再先后与培养的细胞等体积混合,每次反应10分钟后即可进行化学发光检测。并且化学发光非常稳定,在反应开始后的30分钟内,萤火虫萤光素酶的信号下降不超过20%,海肾萤光素酶的信号下降不超过30%,反应至60分钟两种萤光素酶均可保持60%以上的信号。
本产品的Dual-Lumi™海肾萤光素酶检测试剂对萤火虫萤光素酶的淬灭效果好。本试剂盒中的Dual-Lumi™海肾萤光素酶检测试剂中含有抑制萤火虫萤光素酶催化luciferin发光的物质,Dual-Lumi™海肾萤光素酶检测试剂加入后、通过简单的混匀,就可以抑制约99.9%以上的萤火虫萤光素酶信号,大大提高了后续海肾萤光素酶活性检测的精准性。
本产品稳定性好。本试剂盒中的Dual-Lumi™萤火虫萤光素酶检测试剂、Dual-Lumi™海肾萤光素酶检测缓冲液和Dual-Lumi™海肾萤光素酶检测底物(100X)的稳定性均较好。Dual-Lumi™萤火虫萤光素酶检测试剂反复冻融5次对检测效果基本无影响,反复冻融10次检测效果下降不超过5%;4℃保存1天检测效果下降不到10%,4℃保存3天检测效果下降不超过30%;室温保存1天可保留75%以上的检测效果,室温保存3天可保留50%以上的检测效果;37℃保存1天可保留60%以上的检测效果。Dual-Lumi™海肾萤光素酶检测缓冲液反复冻融10次检测效果下降不到10%, 4℃和室温保存3天、37℃保存1天,对检测效果的影响均不超过5%。Dual-Lumi™海肾萤光素酶检测底物(100X)在4℃保存1周、室温保存1天检测效果下降不到10%,室温保存3天、37℃保存1天,仍可保留80%以上的活力。
本产品使用灵活便捷。本产品不仅适合少量样品的检测,也非常适合大量样品的高通量检测(high-throughput screening)。本产品不仅可以等体积加入到细胞培养孔中进行直接检测,也可以先使用RG132S/M双萤光素酶报告基因细胞裂解液裂解并收集细胞后再用本产品进行检测。
本产品兼容性强。本产品兼容各种常见培养液,正常培养液中的酚红、10%以内的胎牛血清或小牛血清、2%以内的DMSO或乙醇对信号和稳定性基本没有影响,常用的盐类或金属离子在正常浓度下也基本没有影响。
关于碧云天萤光素酶报告基因检测试剂盒相关产品的比较和选择,请参考碧云天的相关网页:
http://www.beyotime.com/support/luciferase-reporter-gene-assay.htm
萤光素、萤光素酶、萤火虫萤光素酶和海肾萤光素酶也经常被称作荧光素、荧光素酶、萤火虫荧光素酶和海肾荧光素酶。
萤火虫萤光素酶是一种分子量约为61kD的蛋白,在ATP、镁离子和氧气存在的条件下,可以催化luciferin氧化成oxyluciferin,在luciferin氧化的过程中,会发出波长为560nm左右的生物萤光(bioluminescence)。海肾萤光素酶是一种分子量约为36kD的蛋白,在氧气存在的条件下,可以催化腔肠素(Coelenterazine)氧化成coelenteramide,在coelenterazine氧化的过程中会发出波长为480nm左右的生物萤光。生物萤光可以通过化学发光仪(luminometer)或液闪测定仪进行测定。通过萤光素酶和其底物这一生物发光体系,可以非常灵敏、高效地检测基因的表达。通常把感兴趣基因的转录调控元件或5’启动子区克隆在luciferase的上游,或把3’-UTR区克隆在luciferase的下游等,构建成报告基因(reporter gene)质粒。然后转染细胞,用适当药物等处理细胞后裂解细胞,测定萤光素酶活性。通过萤光素酶活性的高低来判断药物处理等对目的基因的转录调控作用。Renilla luciferase相对更多地被用作转染效率的内参,以消除细胞数量和转染效率的差异。本试剂盒的检测原理参考图3。在加入Dual-Lumi海肾萤光素酶检测工作液的同时,可以充分终止萤火虫萤光素酶催化的化学发光反应。
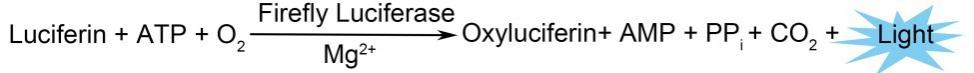

图3. 双萤光素酶的检测原理图。
对于96孔板,推荐使用100μl细胞培养液和100μl的Dual-Lumi™萤火虫萤光素酶检测试剂和100μl的Dual-Lumi™海肾萤光素酶检测试剂,总体积为300μl,此时本试剂盒可以进行100次或1000次检测。对于384孔板,推荐使用25μl细胞培养液和各25μl的检测试剂,总体积为75μl,此时本试剂盒可以进行400次或4000次检测。也可以用其它体积的试剂进行检测,但细胞培养液和各检测试剂体积的比例须为1:1。虽然我们有检测数据显示适当减少检测试剂的用量很可能仍然会得到较好的检测结果,但对于细胞数量偏多、细胞数量特别少或者重复性要求比较高的情况,建议按照推荐用量进行检测。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| RG088S-1 | Dual-Lumi™萤火虫萤光素酶检测试剂 | 10ml |
| RG088S-2 | Dual-Lumi™海肾萤光素酶检测缓冲液 | 10ml |
| RG088S-3 | Dual-Lumi™海肾萤光素酶检测底物(100X) | 100μl |
| — | 说明书 | 1份 |
| 产品编号 | 产品名称 | 包装 |
| RG088M-1 | Dual-Lumi™萤火虫萤光素酶检测试剂 | 100ml |
| RG088M-2 | Dual-Lumi™海肾萤光素酶检测缓冲液 | 100ml |
| RG088M-3 | Dual-Lumi™海肾萤光素酶检测底物(100X) | 1ml |
| — | 说明书 | 1份 |
保存条件:
-80℃保存,至少一年有效;Dual-Lumi™萤火虫萤光素酶检测试剂和海肾萤光素酶检测底物(100X)须避光保存。Dual-Lumi™萤火虫萤光素酶检测试剂-20℃保存,推荐3-6个月内使用;Dual-Lumi™海肾萤光素酶检测缓冲液和海肾萤光素酶检测底物(100X) -20℃保存,一年有效。
注意事项:
本试剂盒中的Dual-Lumi™萤火虫萤光素酶检测试剂在-20℃保存其检测效果会逐渐下降,保存半年后其发光效果会降低约40%。因此,本产品如果保存于-20℃,推荐在3-6个月内使用。如果订购后可能放置较长时间后再使用,推荐订购在-20℃保存非常稳定的Dual-Lumi™ II萤火虫萤光素酶检测试剂盒(RG089)。
由于萤光素酶的活性对温度比较敏感,所以反应前细胞、Dual-Lumi™萤火虫萤光素酶检测试剂及Dual-Lumi™海肾萤光素酶检测缓冲液均需达到室温后再进行测定。可将检测试剂和检测缓冲液在室温或不超过25℃的水浴中融解并混匀后使用。
尽管经测试Dual-Lumi™萤火虫萤光素酶检测试剂反复冻融5次对于检测效果无显著影响,为保证本产品的稳定性、取得良好的使用效果,第一次解冻后可以采取适当分装后避光保存的方法,以避免反复冻融和长时间暴露于室温。Dual-Lumi™萤火虫萤光素酶检测试剂和Dual-Lumi™海肾萤光素酶检测缓冲液在反复冻融过程中,可能会导致检测试剂中出现少量沉淀,此时宜平衡至室温,并尽量溶解。如仍有残留的不溶物,可以离心去除后使用,经测试不会影响后续的检测效果。
请使用适合于细胞培养的白色或黑色的96孔板或384孔板。如果使用普通透明的96孔板或384孔板,相邻孔之间会产生相互干扰。推荐使用碧云天的BeyoGold™全黑96孔细胞培养板(FCP966)或BeyoGold™全白96孔细胞培养板(FCP968)。
Dual-Lumi™海肾萤光素酶检测底物(100X)配制在含有高浓度乙醇的溶液中。由于乙醇容易挥发,有时会在初次使用时发现体积明显小于所标示的包装体积100μl或1ml的情况,此时用无水乙醇把体积补足至100μl或1ml,并混匀后即可使用。
Dual-Lumi™海肾萤光素酶检测工作液宜配制后立即使用。如不能立即使用,-20℃可以保存一周。随着保存时间的延长检测效果会不断下降,因此不可配制成工作液后长期保存。
待测药物的溶剂含量较高时可能会干扰萤光素酶反应,从而影响化学发光信号。可以通过设置含有溶剂的细胞培养液对照孔排除溶剂的干扰。经测试,最终反应体系中DMSO含量在2%以内不会对反应产生影响。
如果希望先裂解并收集细胞样品,然后再使用本试剂盒进行检测,须单独采购RG126S/M萤火虫萤光素酶报告基因细胞裂解液。其它裂解液未经测试。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 细胞的准备:
使用适合进行化学发光检测的96孔板,每孔接种100μl细胞(如使用384孔板,每孔接种25μl细胞,具体用量视不同类型的384孔板而定),同时设置不含细胞的培养液孔作为阴性对照,按照细胞培养和细胞转染的常规方法培养和转染细胞。如有需要,可加入药物处理细胞。
注:如果使用每孔的最大体积小于300μl的非标准96孔板,可适当减少细胞培养液体积,如每孔90μl,同时后续的试剂也同等减少。非标准384孔板等也可类似操作。
2. 检测试剂的准备:
a. 融解Dual-Lumi™萤火虫萤光素酶检测试剂和Dual-Lumi™海肾萤光素酶检测缓冲液,并达到室温。Dual-Lumi™海肾萤光素酶检测底物(100X) 置于冰浴或冰盒上备用。
b. 按照检测每个样品需100μl Dual-Lumi™海肾萤光素酶检测工作液的量,配制适量Dual-Lumi™海肾萤光素酶检测工作液。按照1:100的比例混合适量的Dual-Lumi™海肾萤光素酶检测底物(100X)和Dual-Lumi™海肾萤光素酶检测缓冲液,即配制成Dual-Lumi™海肾萤光素酶检测工作液。例如,5ml Dual-Lumi™海肾萤光素酶检测缓冲液中加入50μl Dual-Lumi™海肾萤光素酶检测底物(100X)充分混匀后即可配制成约5ml Dual-Lumi™海肾萤光素酶检测工作液。注:严格来说100X底物需要按照1:99进行稀释和配制,为便于计算和操作,按照1:100进行操作也可以获得一致的检测效果。
3. 萤光素酶检测:
a. 萤火虫萤光素酶的检测:
(a)取出细胞培养板在室温平衡10分钟(通常不宜超过30分钟)。
(b)96孔板每孔加入100μl Dual-Lumi™萤火虫萤光素酶检测试剂(384孔板每孔25μl),混匀。
(c)室温(约25℃)孵育10分钟,使发光信号趋于稳定。
(d)使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。请根据仪器要求设置相应的参数,每个孔的检测时间一般为0.25-1秒或更长时间,具体需根据仪器的检测灵敏度进行适当的调整。
b. 海肾萤光素酶的检测:
(a)96孔板每孔加入100μl Dual-Lumi™海肾萤光素酶检测工作液(384孔板每孔25μl),混匀。
(b)室温(约25℃)孵育10分钟,使发光信号趋于稳定。
(c)使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。
c. 在以海肾萤光素酶为内参的情况下,用萤火虫萤光素酶测定得到的RLU值除以海肾萤光素酶测定得到的RLU值。根据得到的比值来比较不同样品间目的报告基因的激活程度。如果以萤火虫萤光素酶为内参,也可以进行类似计算。
4. 裂解并收集细胞后的检测(本步骤仅当细胞量比较大的情况下,例如细胞培养在培养皿或6孔板中时,可以考虑采用):
a. 对于贴壁细胞:吸尽细胞培养液后,参考下表加入适量的RG126S/M萤火虫萤光素酶报告基因细胞裂解液;对于悬浮细胞:离心去上清后,参考下表加入适量萤火虫萤光素酶报告基因细胞裂解液。
| 器皿类型 | 96孔板 | 48孔板 | 24孔板 | 12孔板 | 6孔板 |
| 报告基因细胞裂解液(μl/孔) | 100 | 150 | 200 | 300 | 500 |
注:如果萤光素酶的表达水平比较低,可以尝试使用更少的裂解液,例如6孔板的每孔用量可以最小为100微升。
b. 充分裂解后,10,000-15,000g离心3-5分钟,取上清用于测定。
注:细胞裂解后可立即测定萤光素酶,也可以先冻存,待以后再测定。冻存样品需融解,并达到室温后再进行测定。
c. 取20μl样品,加入100μl已经融解并平衡至室温的Dual-Lumi™萤火虫萤光素酶检测试剂,适当混匀。
d. 室温(约25℃)孵育5分钟,使发光信号趋于稳定。注意:如果对于数据的稳定性的要求不太高,可以忽略本步骤,在混匀后立即进行化学发光检测。
e. 使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。请根据仪器要求设置相应的参数,每个孔的检测时间一般为0.25-1秒或更长时间,具体需根据仪器的检测灵敏度进行适当的调整。
f. 加入100μl已经平衡至室温的Dual-Lumi™海肾萤光素酶检测工作液,适当混匀。
g. 使用具有检测化学发光功能的多功能酶标仪进行化学发光检测。
常见问题:
1. Luminometer和荧光分光光度计有何不同?
荧光分光光度计检测的样品本身不能发光,样品需要由特定波长的激发光激发,然后才能产生荧光并被荧光分光光度计检测。Luminometer检测的样品本身可以发光,不需要激发光进行激发。也就是说luminometer是检测化学发光(萤光)的仪器。有些型号的荧光分光光度计也具有luminometer的功能,即也可以检测化学发光。您所使用的荧光分光光度计能否用于化学发光的测定请仔细阅读该仪器的说明书。
2. 可以进行萤光素酶报告基因检测的仪器是否就可以用于本试剂盒的检测?
是。萤光素酶报告基因的检测原理和本试剂盒的原理相同,可以用相同的仪器测定。
相关产品: