碧云天的离心柱式RNAeasy™动物RNA抽提试剂盒(RNAeasy™ Animal RNA Isolation Kit with Spin Column)是一种基于离心柱法从动物组织或培养的动物细胞中安全、快速、便捷、稳定、高效、高质量地抽提长度大于200个核苷酸(nucleotide, nt)的RNA的试剂盒。抽提获得的大于200个核苷酸的RNA(也常被称为总RNA)可以用于各种常规用途。
本试剂盒抽提得到的RNA可用于反转录、RT-PCR、qPCR、Northern、点杂交(Dot Blot)、纯化mRNA、体外翻译、RNase protection assay、cDNA克隆等下游实验;也可用于基因表达芯片分析(microarray)、高通量测序(high throughput
sequencing)等对RNA质量要求较高的情况。
碧云天的三款离心柱式及Trizol法RNA抽提试剂盒的主要特点和差异如下:
| 产品编号 | R0024/ R0026/ R0027 | R0028 | R0032 | R0011/R0016 |
| 产品名称 |
RNAeasy™动物RNA 抽提试剂盒 |
RNAeasy™动物小RNA 抽提试剂盒 |
RNAeasy™ Plus动物RNA 抽提试剂盒 |
Beyozol Trizol |
| 推荐指数 | ★★★★★ | ★★★★★ | ★★★ | ★★ |
| 抽提方式 | 离心柱式 | 离心柱式 | 离心柱式 | 原始方式 |
| 抽提产物 | RNA(>200nt) | 小RNA(<200nt) | 总RNA(含<200nt的小RNA) | 总RNA(含<200nt的小RNA) |
| 操作时间 | 最短(15-20分钟) | 稍较长(20-25分钟) | 较长(25-30分钟) | 最长(45-60分钟) |
| 操作步骤 | 4步骤(少) | 6步骤(多) | 6步骤(多) | 很多步骤 |
| 使用便捷性 | ★★★★★ | ★★★★ | ★★★★ | ★★ |
| 推荐细胞量/得率 | 50-100万/5-20μg | 50万/1-2μg | 50-100万/5-20μg | 50-100万/5-20μg |
| 推荐组织量/得率 | 5-20mg/10-40μg (多) | 5mg/1-1.5μg (少) | 3-5mg/3-10μg (少) | 50mg/100-500μg (很多) |
| RNA纯度 | 高 | 高 | 高 | 高 |
| 有毒有害试剂 | 无 | 无 | 无 | 有 |
| 人体与环境安全 | 高 | 高 | 高 | 低 |
| 国外同类产品 |
RNeasy Mini Kit (Qiagen) PureLink® RNA Mini Kit (Thermo) |
PureLink® miRNA Isolation Kit (Thermo) | miRNeasy Mini Kit (Qiagen) | TRIzol (Thermo) |
| 用途 | 非小RNA相关各种用途 | 小RNA相关各种用途 | 不同长度RNA各种用途 | 不同长度RNA各种用途 |
动物组织或细胞中的RNA按照长度可以分为长链RNA(long RNA)和小RNA(small RNA),长链RNA通常大于200nt,而小RNA通常小于200nt。长链RNA按照是否编码蛋白或多肽可以分为长链非编码RNA(long noncoding RNA, lncRNA)和mRNA。小RNA主要包括非编码的5.8S rRNA(ribosomal RNA)、5S rRNA、tRNA(transfer RNA)、microRNA(miRNA)、siRNA(small interfering RNA)、piRNA(Piwi-associated small RNA)、tsRNA(tRNA-derived small RNA)、srRNA(small rDNA-derived RNA)等。
本试剂盒抽提RNA的基本流程如图1所示。样品在裂解液中迅速裂解,释放出总RNA,然后让RNA特异性地结合到纯化柱上,而基因组DNA和蛋白质等其它组分通过高速离心被有效去除,再通过3次洗涤充分去除非特异性结合的蛋白、盐等杂质,最后用洗脱液将高纯度的RNA洗脱下来。
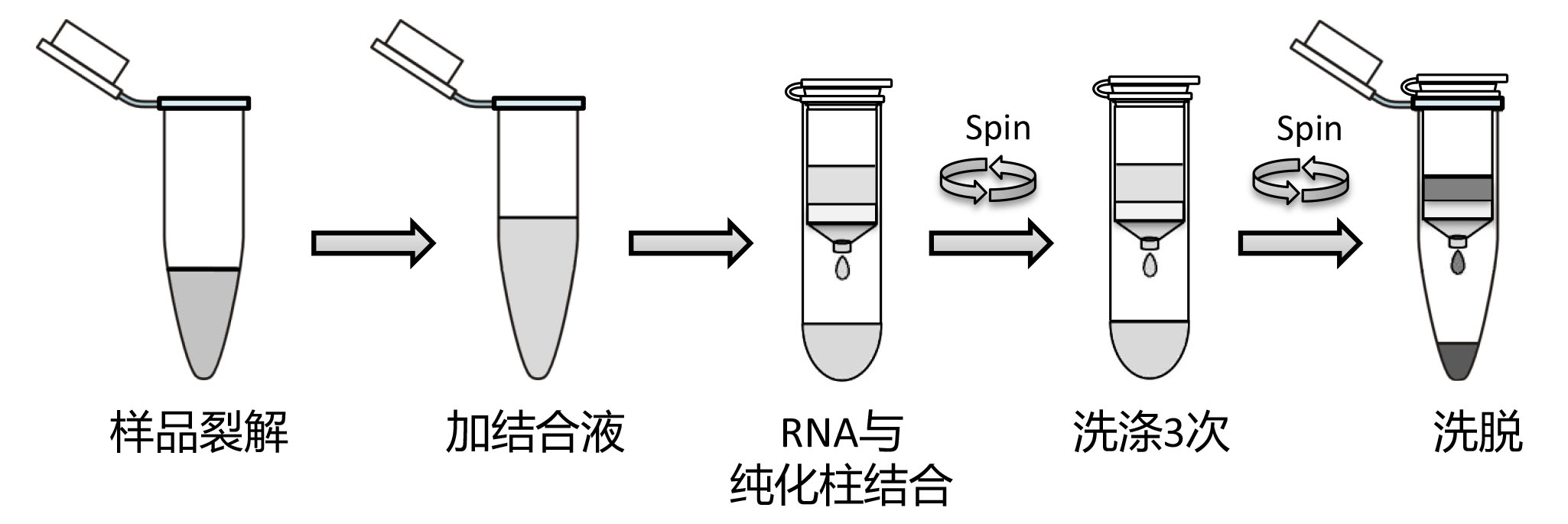
图1. 离心柱式RNA抽提流程示意图
本试剂盒使用安全。本试剂盒通过特殊的柱纯化介质进行RNA分离纯化,能有效避免传统的Trizol法抽提时使用的酚、氯仿等有毒有害有机试剂。
本试剂盒使用快速、便捷。本试剂盒采用柱纯化,无需繁琐的RNA沉淀步骤,抽提操作过程仅15-20分钟。相比于传统的Trizol抽提法,本试剂盒的操作流程显著简化,缩短了抽提时间,降低了RNA被降解的风险。和国外同类柱纯化产品相比,所需操作步骤和操作时间基本一致。
本试剂盒抽提RNA的得率高,优于国外同类产品。本试剂盒的抽提效果经反复测试,100万个HeLa细胞能抽提得到约15-20μgRNA,20mg小鼠肝组织能抽提得到约25-35μgRNA,20mg小鼠脑组织中抽提得到约10-20μgRNA(新鲜样品的得率高于冻存样品)。本试剂盒与传统的Trizol方法及国际知名Q品牌同类产品的抽提效果对比参见图2。
本试剂盒抽提得到的RNA纯度高,显著优于Trizol和国外Q品牌的同类产品。本试剂盒抽提得到的RNA的A260/A280通常为2.0-2.2。A260/A230通常为1.9-2.1。本试剂盒与传统的Trizol方法及国际知名Q品牌同类产品的抽提效果对比参见图2。由图2可知,本试剂盒在抽提组织样品的RNA时,A260/A230非常显著地高于Trizol法和Q品牌的同类产品,提示纯度高。
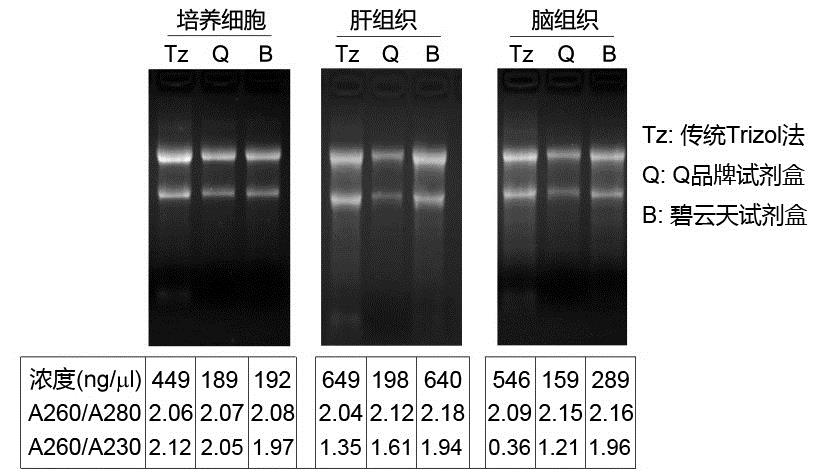
图2. 本试剂盒与Trizol、Q品牌同类产品的RNA抽提效果对比。样品为冻存的50万个HeLa细胞、20mg小鼠肝组织和20mg小鼠脑组织。洗脱液用量均为40μl。均取6μl洗脱的样品经变性处理后,在含6.67%甲醛和适量NA-Red的1.2%变性琼脂糖凝胶中电泳约45分钟后拍照。实际抽提效果会因实验条件、检测仪器等的不同而存在差异,本图仅供参考。
注:纯的RNA其A260/A280约为2.0,但在很多仪器上测定时会高于2.0,低于1.9通常认为有蛋白、DNA或者酚等的污染;纯的RNA其A260/A230约为2.0左右或者略高,低于1.9通常认为有碳水化合物、胍盐、多肽或酚等的污染。
本产品与Qiagen公司的RNeasy Mini Kit一致,用于纯化200nt以上的RNA,对小于200nt的small RNA即小RNA(如5.8S rRNA、5S rRNA、tRNA、miRNA、piRNA等)被选择性地去除,如果希望抽提得到小于200nt的小RNA,推荐使用碧云天的
RNAeasy™动物小RNA抽提试剂盒(离心柱式)(R0028)或RNAeasy™ Plus动物RNA抽提试剂盒(离心柱式)(R0032)。
本试剂盒适用于新鲜或冻存的动物组织或细胞RNA的抽提,推荐的细胞用量为50-100万(上限可达1000万),组织用量为15-20mg(上限可达30mg)。对于不同的组织或细胞上限会有所差别,例如小鼠肝脏组织的上限可达30mg,但肌肉组织的上限为20mg。
本试剂盒可用于12个样品的RNA抽提。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| R0024-1 | 裂解液 | 8ml |
| R0024-2 | 结合液 | 8ml |
| R0024-3 | 洗涤液I | 8ml |
| R0024-4 | 洗涤液II | 15ml |
| R0024-5 | 洗脱液 | 1.2ml |
| R0024-6 | RNA纯化柱及废液收集管 | 12套 |
| R0024-7 | RNA洗脱管 | 12个 |
| — | 说明书 | 1份 |
保存条件:
室温保存,一年有效。
注意事项:
对于富含RNase的样品(如动物组织),建议使用前在裂解液中添加二硫苏糖醇(Dithiothreitol, DTT)至终浓度为40mM (例如1ml裂解液中加入20μl 2M DTT)或β-巯基乙醇至终浓度为1% (如1ml裂解液中加入10μl β-巯基乙醇)。含DTT或β-巯基乙醇的裂解液可在室温放置1个月。
通过本试剂盒抽提得到的RNA已经去除绝大多数DNA,通常情况无需DNase处理。后续如进行某些对DNA残留较敏感的实验时,可以在使用说明中步骤4离心后,在纯化柱中加入适量DNase I进行消化,具体请参考使用说明。
本试剂盒提供的所有试剂和耗材都是RNase-free,操作时应小心,避免被污染。所有自行准备的试剂和耗材也都应是RNase-free。如果可能有RNase污染,可考虑用0.01%的DEPC水浸泡过夜,然后高温高压灭菌并烘干。操作时应避免对着样品或所使用的试剂盒耗材呼气或说话,以防RNase污染。建议戴一次性口罩操作。
对于操作环境中RNA酶的去除,推荐使用碧云天生产的RNase and DNase Away (R0123)以去除实验桌面上或其它接触面上的RNase。
使用冻存的细胞或组织抽提RNA的效果通常比新鲜的细胞或组织差一些。因为在细胞或组织冻融过程中一些细胞或组织内的RNase会被释放出来并剪切样品中的RNA。对于组织样品,推荐使用碧云天生产的RNALater™动物组织RNA稳定保存液(R0118)进行保存以保证样品RNA的完整性。
本试剂盒所有操作均在室温进行,操作时无需冰浴。所有离心也均在室温进行。
废液收集管在一次抽提中需多次使用,切勿中途丢弃。
结合液、洗涤液中含有乙醇,使用后须旋紧瓶盖以防挥发,并须按照易燃试剂的相关规范进行存放和使用。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.样品的准备。
细胞样品:收集50-100万左右的细胞。对于悬浮细胞,1000-2000×g离心1分钟后弃上清,加入300μl裂解液,轻轻吹打8-10次至固悬物溶解、溶液澄清;对于贴壁细胞,吸净培养液后加入300μl裂解液,轻轻吹打5-10次至固悬物溶解、溶液澄清,转移至一洁净离心管内。
组织样品:取15-20mg动物组织,置于液氮中研磨成粉末,立即加入600μl裂解液。也可将组织置于1.5ml离心管中,迅速加入600μl冰浴预冷的裂解液,用微型电动匀浆器匀浆,或者用普通玻璃匀浆器进行匀浆。研磨或匀浆后,轻轻吹打匀浆液8-10次,室温放置3-5分钟。然后约14,000×g离心2分钟,将上清液移至新的离心管中。对于比较容易裂解且匀浆很充分的组织(如肝组织、脑组织等)可以不用高速离心而直接进入步骤2。
注意:细胞的数量一般不超过500万,不超过100万细胞宜使用300μl裂解液,多于100万细胞宜使用600μl裂解液。动物组织的用量一般不超过30mg,用量过多可能会因裂解不充分导致得率下降。组织样品在裂解和离心后,离心管下部可能会有一些胶状物质,宜作为上清转移至下一步操作。如果弃除胶状物,会导致得率下降约30-50%。后续加入结合液后胶状物会消失。离心是为了去除未匀浆充分的明显块状物。如果裂解后仍有粘稠物,需增加吹打次数至溶液完全澄清。对于富含RNase的样品,裂解液中宜添加DTT至终浓度为40mM或添加β-巯基乙醇至终浓度为1%。
2.加入等体积结合液至裂解液中,轻轻颠倒混匀3-5次。此时可能会有沉淀物产生,属于正常现象。
3.将混合物(包括沉淀物)转移至纯化柱内,12,000×g离心30秒,倒弃收集管内液体。
注意:当裂解液的体积大于300μl时,在加入等体积结合液后,总体积会超过纯化柱的容量,这时应分成2次过柱,即将一半的混合物过柱后,再将剩余的混合物重复步骤3一次。对于一些特殊的样品,如出现溶液未完全通过时,可延长离心时间至1-2分钟,或者加大离心力至16,000×g。对于一些能快速启动达到12,000×g的离心机,离心30秒已经足够,对于一些启动速度缓慢的离心机本步骤及后续步骤中的30秒离心宜调整为60秒。
4.加入600μl洗涤液I,12,000×g离心30秒,倒弃收集管内液体。选做:通过本试剂盒抽提得到的RNA已经去除绝大多数DNA,通常情况无需DNase处理。后续如进行某些对DNA残留较敏感的实验时,可在本步骤离心后,在纯化柱中加入80µl含10U DNase I的酶溶液(推荐使用碧云天RNase-free的DNase I,D7073或D7076,每80µl酶溶液按照71.8µl水加8µl 10X Reaction Buffer再加0.2µl 50U/μl DNase I混合配制而成),室温放置消化15分钟。消化结束后,不需要进行离心等任何额外的操作,直接进入步骤5。
5.加入600μl洗涤液II,12,000×g离心30秒,倒弃收集管内液体。
6.重复步骤5一次。
7.最高速(约14,000-16,000×g)离心2分钟,去除残留的液体。
8.将RNA纯化柱置于本试剂盒提供的RNA洗脱管中,加入30-50μl洗脱液,室温放置2-3分钟,最高速离心30秒,所得溶液即为纯化的RNA。
注意:洗脱液需要加到纯化柱柱面中央,使其被完全吸收。如需获得更高浓度的样品,可把洗脱液的体积减小至20μl,但洗脱下来的RNA量会相对减少。室温较低时,洗脱液在37℃预热片刻对得率有所帮助。此外,洗脱后的溶液再次加回到原纯化柱再离心洗脱一次,可提高得率约10-30%;或者在第一次洗脱后使用新的洗脱液再洗脱一次,会获得约为第一次洗脱量15-40%的RNA。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| R0011 | Beyozol (总RNA抽提试剂) | 100ml |
| R0016 | Trizol (总RNA抽提试剂) | 100ml |
| R0021 | DEPC水(DNase、RNase free) | 100ml |
| R0022 | DEPC水(DNase、RNase free) | 500ml |
| R0024 | RNAeasy™动物RNA抽提试剂盒(离心柱式) | 12次 |
| R0026 | RNAeasy™动物RNA抽提试剂盒(离心柱式) | 50次 |
| R0027 | RNAeasy™动物RNA抽提试剂盒(离心柱式) | 200次 |
| R0028 | RNAeasy™动物小RNA抽提试剂盒(离心柱式) | 50次 |
| R0032 | RNAeasy™ Plus动物RNA抽提试剂盒(离心柱式) | 50次 |
| R0035 | BeyoMag™磁珠法动物总RNA抽提试剂盒 | 50次 |
| R0118 | RNALater™动物组织RNA稳定保存液 | 100ml |
| R0121-25ml | AllProtect™动物组织核酸、蛋白稳定保存液 | 25ml |
| R0121-100ml | AllProtect™动物组织核酸、蛋白稳定保存液 | 100ml |
| R0123 | RNase and DNase Away | 250ml |
| R0125 | RNase, DNase and DNA Away | 250ml |
| R0127 | RNase, DNase, RNA and DNA Away | 250ml |
| ST036 | DEPC | 10g |