碧云天的线粒体通透性转换孔检测试剂盒(Mitochondrial Permeability Transition Pore Assay Kit or MPTP Assay Kit)是一种采用膜通透性的荧光探针Calcein AM检测线粒体通透性转换孔开放程度的试剂盒,也常用于研究细胞凋亡、坏死等细胞死亡。本试剂盒比基于线粒体膜电位的方法能更直接地检测到线粒体通透性转换孔开放程度的变化。
线粒体(mitochondrial)是细胞的能量中心,同时在细胞凋亡和坏死性细胞死亡过程中有着非常重要的作用。线粒体通透性转换孔(mitochondrial permeability transition pore, MPTP或mPTP),又称线粒体巨型通道(mitochondrial megachannel, MMC),是一种由线粒体膜内膜和外膜组成的非特异性的通道,在细胞死亡过程中参与线粒体内物质的释放。线粒体通透性转换孔的开放是引起细胞死亡的关键事件,在细胞的生存和凋亡的调控过程中扮演着重要角色,同时线粒体通透性转换孔在心肌缺血、再灌注损伤、创伤性脑损伤、中风等心血管疾病及肿瘤、衰老、神经变性等多个方面都有重要作用。
在健康的细胞中,线粒体内膜可维持正常的线粒体膜电位梯度以保证细胞呼吸及能量供应。随着Ca2+被线粒体摄入和释放,其通透性转换孔在张开和闭合状态中来回切换。但在细胞凋亡或死亡的过程中,线粒体通透性转换孔的开放显著改变了线粒体的通透性。持续的线粒体通透性转换孔开放,导致Ca2+过载、线粒体氧化型谷胱甘肽、线粒体中活性氧水平升高,最终导致细胞色素C的释放及线粒体膜电位降低和消失。同时,线粒体通透性转换孔具有感受器的功能,如Ca2+的过载、细胞色素C的释放及膜电位的消失等也会诱导该孔的持续激活。
线粒体通透性转换孔检测试剂盒的检测原理如下。试剂盒使用荧光探针钙黄绿素乙酰甲酯(calcein acetoxymethyl ester, 即Calcein AM)染色细胞。Calcein AM是一种可以对活细胞进行荧光染色的非极性染料,可通过被动运输进入细胞内并在细胞质组分包括线粒体等中积累。在细胞中,几乎没有荧光的Calcein AM被细胞内的酯酶水解去除乙酰甲酯,生成没有膜通透性的极性荧光染料钙黄绿素(Calcein or Fluorexon),从而使Calcein滞留在细胞内,并使细胞质包括线粒体等呈现强绿色荧光。Calcein本身是一种金属络合指示剂,在生理pH条件下和Co2+、Ni2+、Cu2+、Fe3+和Mn2+等金属离子络合时,荧光信号会发生淬灭。本试剂盒提供了CoCl2用于淬灭细胞质中Calcein的绿色荧光,但由于正常情况下线粒体的MPTP是关闭的,此时CoCl2不能进入线粒体,所以Calcein AM染色后经CoCl2处理会导致仅线粒体内呈现Calcein的绿色荧光。作为对照,可将细胞用Calcein AM染色并经过CoCl2处理之后,用钙离子载体Ionomycin进一步处理以诱导细胞外的Ca2+大量进入细胞内和线粒体基质并导致MPTP的开放,或者用适当的条件刺激细胞导致MPTP少量或大量开放,从而使部分Calcein释放进入细胞浆和钴离子结合而失去荧光,同时细胞浆中的钴离子能进入线粒体内而导致其中的Calcein的绿色荧光部分甚至全部淬灭,最终导致线粒体中Calcein绿色荧光减弱或消失。这样就可以根据线粒体中Calcein绿色荧光的强弱来判断线粒体MPTP开放的程度,绿色荧光越强,开放程度越低,绿色荧光越弱开放程度越高。本试剂盒的原理参考图1。
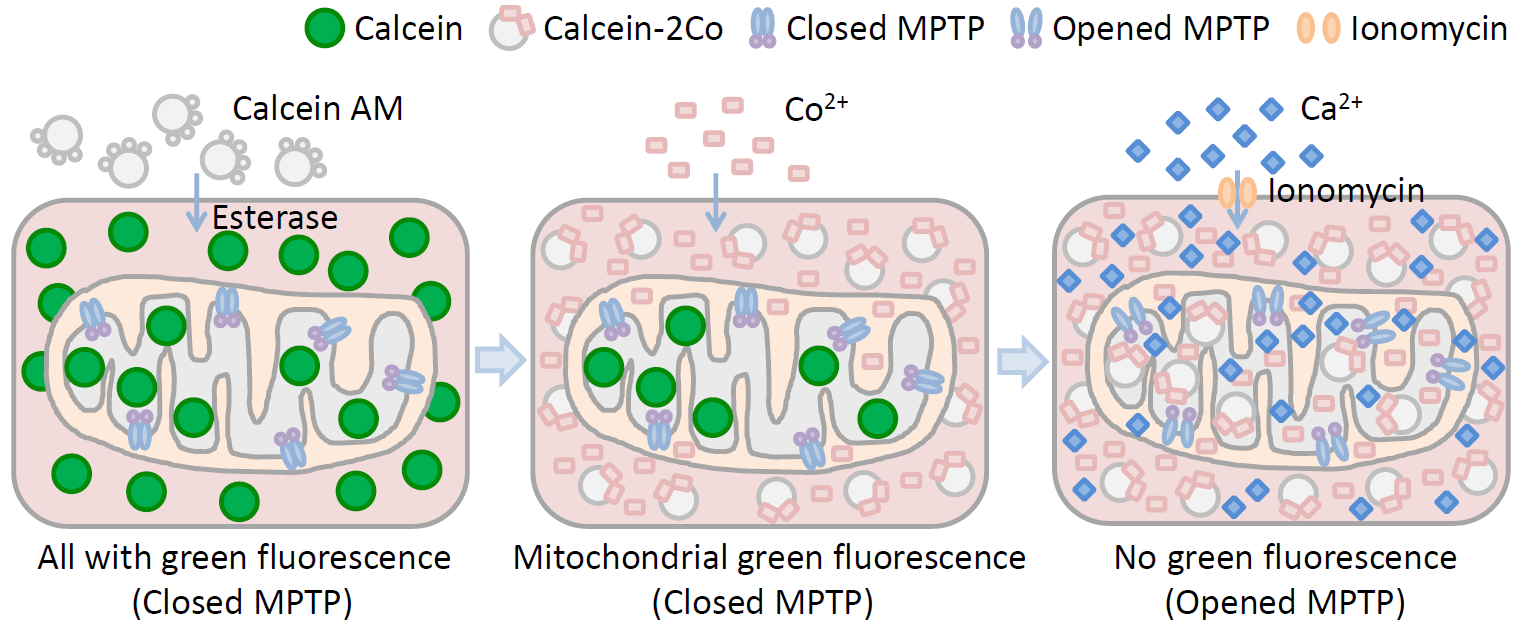
图1. 线粒体通透性转换孔(MPTP)检测试剂盒原理图。Calcein AM进入活细胞后被酯酶(Esterase)催化生成Calcein,整个细胞都呈现很强的绿色荧光;氯化钴(含Co2+)处理后呈现绿色荧光的Calcein结合钴离子生成没有荧光的Calcein-2Co,但正常情况下MPTP没有打开从而钴离子不能进入线粒体,因此此时仅线粒体中呈现绿色荧光;进一步用Ionomycin处理后,使钙离子进入细胞内,导致MPTP打开,使部分Calcein从线粒体内释放,同时钴离子进入线粒体内从而使线粒体内呈现绿色荧光的Calcein也生成了没有荧光的Calcein-2Co。如果有样品可以诱导MPTP的部分或全部打开,就会导致线粒体中的绿色荧光减弱甚至消失。
Calcein AM水解产物Calcein的最大激发光波长为494nm,最大发射光波长为517nm。Calcein的激发光谱和发射光谱参考图2。
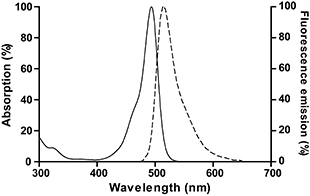
图2. Calcein的激发光谱和发射光谱。
本试剂盒内提供了1000X的Calcein AM,为了得到满意的结果,对于不同的细胞类型请自行进行一定摸索,Calcein AM的终浓度一般为0.1X-5X,最优先的推荐终浓度为1X。使用本试剂盒检测线粒体通透性转换孔开放的效果参考图3。
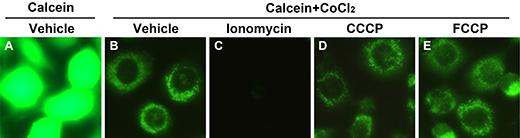
图3. 使用线粒体通透性转换孔(MPTP)检测试剂盒检测MPTP开放的效果图。Calcein AM (1X)与L-929细胞进行孵育,细胞质包括线粒体发出强绿色荧光(A);细胞进一步与CoCl2 (1X)孵育以后,细胞质内Calcein的绿色荧光被CoCl2淬灭,仅留下线粒体内的绿色荧光(B);使用Ionomycin (1X)处理细胞,诱导细胞外的Ca2+大量进入细胞内,过多的Ca2+进入线粒体基质,导致MPTP的开放,使部分Calcein从线粒体内释放,同时使钴离子进入线粒体内并导致Calcein的绿色荧光淬灭(C);使用解耦联剂CCCP和FCCP (5μM)处理细胞,虽然线粒体膜电位丢失,但短时间内不会直接引起MPTP的开放,因此线粒体内绿色荧光强度无明显变化(D、E)。
由于Calcein AM的毒性特别低,并且不会抑制细胞的增殖、趋化性等绝大部分功能,所以与其它同类产品如CFDA SE等相比是更适合染活细胞的荧光探针。
本试剂盒小包装C2009S,如果用于流式细胞仪,每个样品的检测体系体积为1ml时,可以进行100次检测;96孔板每孔检测体系的体积为100μl时可以检测1000次。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C2009S-1 | 检测缓冲液 | 200ml |
| C2009S-2 | Calcein AM (1000X) | 110μl |
| C2009S-3 | CoCl2 (100X) | 1ml |
| C2009S-4 | Ionomycin (200X) | 600μl |
| C2009S-5 | 促溶剂(100X) | 1.2ml |
| - | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。Calcein AM (1000X)和Ionomycin (200X)需要避光保存。
注意事项:
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
Calcein AM (1000X)须尽量避免反复冻融。如果多次使用,请注意适当分装。
CoCl2有腐蚀性,对人体有害或有刺激性,对人体有呼吸道、生殖等特定器官毒性,或致畸致癌毒性,操作时请小心,并确保有效防护以避免直接接触人体或吸入体内,并须注意避免腐蚀其它物品。
CoCl2对水生生物有毒或有害,禁止直接排入环境。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.溶液准备:
a.Calcein AM染色液(Calcein AM staining solution)的配制:以10个样品使用流式细胞仪检测为例,需要配制10ml Calcein AM染色液,即取10μl的Calcein AM (1000X)和100μl促溶剂(100X)加入到10ml的检测缓冲液(Assay buffer)中混匀。
注1:促溶剂可增强Calcein AM的水溶性、减少Calcein AM在检测缓冲液中的析出、改善染色效果并降低荧光背景。促溶剂非必须,特殊情况下也可不添加于检测缓冲液中。
注2:Calcein AM染色液建议现配制现使用,不能长期保存,请根据待检测的样品数量,计算出Calcein AM染色液的使用量。
注3:本试剂盒中提供的检测缓冲液含有Ca2+,可在一段时间内维持细胞的正常状态,并给细胞提供一定的营养,效果比PBS或HBSS更好;检测缓冲液也可用细胞培养液代替,但培养液中不能含有血清,否则会影响Calcein AM的进入细胞内的效率。
注4:染色液中Calcein AM的最终浓度需根据不同细胞系和实验体系通过预实验进行优化。Calcein AM的推荐工作浓度为1X,可以在0.1X-5X范围内摸索最佳工作浓度。
b.荧光淬灭工作液(Fluorescence quenching solution)的配制:在Calcein AM染色液中添加CoCl2 (100X)使其终浓度为1X。例如,每1ml Calcein AM染色液中加入10μl的CoCl2 (100X),混匀。
注:CoCl2的终浓度推荐为1X,通常此时的淬灭效果比较好。CoCl2的终浓度也可以根据实验中所使用细胞的种类进行适当优化,以摸索出最佳的淬灭效果,可在0.1X-1X之间进行调整。
c.Ionomycin对照(Ionomycin control)的配制:在荧光淬灭工作液中加入Ionomycin (200X)使其终浓度为1X。例如,每1ml荧光淬灭工作液中加入5μl的Ionomycin (200X),混匀。
注:Ionomycin的终浓度建议为0.5μM,也可以在0.4X-6X之间进行调整。
d.各种溶液配制见下表(其中检测缓冲液即Assay buffer中根据需要添加促溶剂)。以各配制10ml为例,实际溶液需求量根据实验方案和样品数量而定:
| Solution | Solvent | Reagent | Stock solution concentration | Final concentration | Volume |
| Calcein AM staining solution (a) | Assay buffer | Calcein AM | 1000X | 1X | 10μl |
| Fluorescence quenching solution (b) | a | CoCl2 | 100X | 1X | 100μl |
| Ionomycin control (c) | b | Ionomycin | 200X | 1X | 50μl |
2.贴壁细胞的荧光显微镜检测:
a.将细胞接种于培养皿、多孔细胞培养板或者细胞爬片上,按实验设计对细胞进行一定处理。
b.吸除培养液,用PBS清洗细胞1-2遍。
c.加入适当体积的Calcein AM染色液、荧光淬灭工作液或Ionomycin对照,轻轻晃动使染料均匀覆盖所有细胞。一般96孔板每孔体积为100μl,24孔板每孔体积为250μl,12孔板每孔体积为500μl,6孔板每孔体积为1ml。
d.37℃避光孵育30-45min,不同的细胞最佳孵育时间有所不同。以30min作为初始孵育时间,根据所用细胞对孵育时间进行适当优化以得到最佳效果。
e.孵育结束后,更换成新鲜的37℃预热的培养液,37℃再避光孵育30min,以保证细胞内酯酶充分水解Calcein AM以生成有绿色荧光的Calcein。
f.吸除培养液,用PBS清洗2-3次,然后加入检测缓冲液即可在荧光显微镜下观察。如有需要,也可进行进一步非绿色荧光的染色。如用Annexin V-PE细胞凋亡检测试剂盒(C1065)或细胞凋亡与坏死检测试剂盒(C1056)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。
3.悬浮细胞的荧光显微镜检测:
a.细胞按实验设计进行一定处理后,计数。取适当细胞1000g室温离心5min,弃上清,加入适当体积的Calcein AM染色液、荧光淬灭工作液或Ionomycin对照,使细胞密度约为1×106/ml。
b.37℃避光孵育30-45min,不同的细胞最佳孵育时间有所不同。以30min作为初始孵育时间,根据所用细胞对孵育时间进行适当优化以得到最佳效果。
c.孵育结束后,1000g室温离心5min,吸除上清液,缓慢加入37℃预热的培养液重悬细胞。
d.重复步骤c两次或以上。
e.更换新鲜的37℃预热的培养液,37℃再避光孵育30分钟,以保证细胞内酯酶充分水解Calcein AM以生成有绿色荧光的Calcein。
f.1000g室温离心5min,吸除大部分培养液,将细胞重悬后涂片,在荧光显微镜下观察。如用Annexin V-PE细胞凋亡检测试剂盒(C1065)或细胞凋亡与坏死检测试剂盒(C1056)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。
4.流式细胞仪检测:
a.贴壁细胞胰酶消化后用培养液重悬、悬浮细胞直接使用,计数,取适量细胞1000g室温离心5min,弃上清,加入适当体积的检测缓冲液、Calcein AM染色液、荧光淬灭工作液或Ionomycin对照重悬,使细胞为单细胞悬液,并且细胞密度为1×106/ml,每个样品体积为1ml。注:需要准备好仅含检测缓冲液的细胞样品用作流式细胞仪检测时的阴性对照。
b.37℃避光孵育30min。
c.孵育完成后,1000g室温离心5min收集细胞。每个样品加入1ml检测缓冲液,轻轻重悬,1000g室温离心5min收集细胞。
注:本步骤可去除多余染料及可能引起荧光淬灭的试剂。
d.用400µl检测缓冲液重悬细胞。如有需要,也可进行进一步染色。如用Annexin V-PE细胞凋亡检测试剂盒(C1065)或细胞凋亡与坏死检测试剂盒(C1056)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。染色后,将样品置于冰上,可以在1小时内进行流式细胞仪检测和分析。
e.注意使用仅含检测缓冲液的并且未经染色的细胞样品用于流式细胞仪的阴性对照设置。Calcein的最大激发光波长为494nm,最大发射光波长为517nm。
5.结果示例:
a-仅含Calcein AM:线粒体和细胞质都有绿色荧光,荧光信号较强(参考图3A);
b-含Calcein AM和CoCl2:仅线粒体有绿色荧光,荧光强度中等(参考图3B);
c-含Calcein AM、CoCl2和Ionomycin:线粒体和细胞质绿色荧光均被淬灭,荧光信号比较弱或者几乎没有(参考图3C)。
b和c的绿色荧光信号变化说明线粒体通透性转换孔被打开,从而部分Calcein从线粒体内被释放,同时导致钴离子进入线粒体内而引起其中的Calcein绿色荧光发生淬灭。
相关产品:
| 产品编号 | 产品名称 | 包装 |
| C1031 | CFDA SE (细胞增殖示踪荧光探针) | 5mg |
| C1049-50µg | Mito-Tracker Red CMXRos (线粒体红色荧光探针) | 50µg |
| C1049-250µg | Mito-Tracker Red CMXRos (线粒体红色荧光探针) | 50µg×5 |
| C1056 | 细胞凋亡与坏死检测试剂盒 | 100次 |
| C1065S | Annexin V-PE细胞凋亡检测试剂盒 | 20次 |
| C1065M | Annexin V-PE细胞凋亡检测试剂盒 | 50次 |
| C1065L | Annexin V-PE细胞凋亡检测试剂盒 | 100次 |
| C1071S | 线粒体膜电位与细胞凋亡检测试剂盒 | 20次 |
| C1071M | 线粒体膜电位与细胞凋亡检测试剂盒 | 50次 |
| C2005 | JC-1 | 1mg |
| C2006 | 线粒体膜电位检测试剂盒(JC-1) | >100次 |
| C2009S | 线粒体通透性转换孔(MPTP)检测试剂盒 | 100-1000次 |